Introduction
On reconnaît de plus en plus la capacité des changements climatiques à affecter négativement la santé publique. L’une de ces conséquences des changements climatiques rapportées dans la documentation est une modification de la distribution et de l’habitat des moustiques connus comme vecteurs de transmission de maladies. L’apparition récente du virus Zika et la réémergence des virus de la dengue et du chikungunya en Amérique centrale et en Amérique du Sud ont suscité une inquiétude accrue en ce qui concerne les effets des changements climatiques sur la propagation des maladies à transmission vectorielle au Canada. Bien qu’on ne connaisse pas au Canada de moustiques vecteurs véhiculant ces arbovirus courants, on s’attend à ce que les changements climatiques augmentent la distribution géographique de ces vecteurs (1), exposant ainsi potentiellement les Canadiens aux maladies qu’il transmettent. En outre, compte tenu de l’intensité actuelle du tourisme et du commerce, de même que du manque de vaccins et de traitements médicaux efficaces pour un grand nombre de ces maladies à transmission vectorielle, les professionnels de la santé publique devront pouvoir prédire les effets prévisibles des changements climatiques sur la distribution des vecteurs et s’y préparer.
Le cycle de vie, le mode de reproduction et les comportements alimentaires des moustiques dépendent de la température, des précipitations et de l’occupation du sol. Le Groupe d’experts intergouvernemental des Nations Unies sur les changements climatiques (GIEC) a prédit une augmentation de la température moyenne mondiale de 2 à 6 °C de 1990 à 2100 (2). Parce que les températures minimales progressent de façon disproportionnée par rapport aux températures moyennes et maximales (2), la distribution géographique des conditions climatiques favorables aux moustiques vecteurs de maladies est en expansion, exposant des populations croissantes aux maladies à transmission vectorielle (3). Par exemple, depuis 2004, il y a eu deux épidémies autochtones de dengue dans la zone continentale des États-Unis : une au Texas (2004-2005) (4) et une seconde en Floride (2009 à 2011) (5). Plus récemment, le virus Zika s’est répandu partout dans les Amériques depuis sa première détection au Brésil en 2015, et la plupart des pays d’Amérique latine et des Caraïbes rapportent maintenant des cas de transmission locale (6).
L’objectif du présent document est de fournir un bref survol de la documentation disponible pour renseigner les professionnels et les planificateurs de la santé publique sur les effets prévus des changements climatiques relativement à un groupe donné de maladies transmises aux humains par les moustiques. Le présent document ne cherche pas à offrir un examen systématique, mais plutôt à fournir un survol de la documentation actuelle et un aperçu des tendances prévisibles. Le terme MeSH « changement climatique » a été combiné à « Aedes », « Culex » ou « vecteur de maladie » pour repérer les articles répertoriés dans ce survol. Pour optimiser la pertinence des résultats pour les praticiens canadiens, l’accent a été mis sur les articles portant sur les tendances prévues dans les Amériques.
Maladies véhiculées par les moustiques dans les Amériques
Les trois moustiques dont on a démontré le rôle de vecteur de propagation des arbovirus sont les Aedes albopictus, les Aedes aegypti et toutes les espèces de Culex. On a récemment pu constater les conséquences pour la santé publique dans les Amériques de cette nouvelle distribution des vecteurs avec la propagation du virus de la dengue, l’émergence du virus Zika et la réémergence du virus du chikungunya. (Certains autres virus moins courants, mais qu’on sait être aussi véhiculés par les moustiques, sont énumérés dans le tableau 2, à la fin du présent document.)
Aedes albopictus

La documentation montre qu’Aedes albopictus, communément appelé le moustique tigre asiatique, est l’une des espèces ayant connu la diffusion la plus rapide au cours des deux dernières décennies (7). L’habitat naturel d’Aedes albopictus se trouve en Asie, mais grâce au commerce mondial, il s’est répandu dans tous les continents, à l’exception de l’Antarctique. Dans les études de laboratoire, il s’est avéré être un vecteur compétent pour un certain nombre de maladies (tableau 1). Il a joué un rôle dans la réémergence de la dengue en France et en Croatie (8), ainsi que dans celle du chikungunya en France (9) et dans le nord de l’Italie (10). Depuis 2013, on note une transmission autochtone du chikungunya dans certaines régions des Caraïbes, de l’Amérique latine et des États-Unis (11). Il est également connu comme vecteur passerelle du virus du Nil occidental (VNO), parce qu’il s’alimente sur un vaste éventail d’hôtes, dont les oiseaux (hôtes compétents) et les humains (hôtes incompétents).
Tableau 1. Virus à transmission vectorielle et maladies associées véhiculées par Aedes albopictus
Flavivirus
- Dengue
- Virus du Nil occidental
- Encéphalite japonaise
Bunyavirus
- Jamestown Canyon
- Keystone
- LaCrosse
- Potosi
- Cache Valley
- Tensaw
Alphavirus
- Encéphalite équine de l’Est
Pour sa reproduction, Aedes albopictus préfère les contenants abrités, qu’ils soient naturels ou artificiels, pouvant apporter d’autres ressources comme de l’eau, de la nourriture et une protection physique; c’est pourquoi ils sont classés comme des insectes « se multipliant en récipient » (12). Sa propagation est liée au commerce international des pneus (7) et à l’exportation des pousses de « bambou porte-bonheur » (13). Sa préférence pour une reproduction en récipient est une caractéristique fondamentale, qui l’amène à être souvent associé à des environnements urbains où des contenants artificiels, comme les réservoirs d’eau, les pneus et les bouteilles, sont facilement accessibles (14). De plus, sa capacité à s’alimenter sur un large éventail d’espèces hôtes augmente son potentiel de vecteur de maladies (15); il se nourrit par exemple sur les chevaux dans le cas de l’encéphalite équine du Venezuela et sur les porcs dans celui de l’encéphalite japonaise (16). En outre, sa tendance à l’alimentation diurne améliore grandement son efficacité en tant que vecteur (17).
Un certain nombre d’études ont eu recours, dans le cadre de modèles mathématiques, à des variables comme la précipitation annuelle prévue, la température moyenne annuelle, les températures hivernales minimales, les températures estivales maximales et l’humidité relative pour estimer la distribution mondiale des conditions climatiques favorables à Aedes albopictus (14,15, 18,19). Ces études suggèrent que quel que soit le niveau d’émissions de CO2 utilisé dans les modèles, on peut prévoir que la zone géographique favorable à Aedes albopictus est appelée à s’agrandir dans les scénarios à court, moyen et long terme (14,15, 18,19). Plus précisément, pour l’Amérique du Nord, les études prédisent le triplement, entre 2010 et 2039, de la superficie de territoire au climat favorable dans le nord des États-Unis (14). Les zones où l’on s’attend à ce que ce moustique s’installe s’étendent aussi loin au nord que la rive sud du lac Érié et Buffalo (État de New York), et elles continueront à progresser vers le nord dans les années à venir (14), probablement jusqu’à atteindre les frontières méridionales de deux provinces canadiennes, l’Ontario et le Québec.
L’étude canadienne d’Ogden et al. (15) a analysé trois indicateurs climatiques qui jouent sur la survie d’Aedes albopictus sous le climat actuel et sous celui qu’on prévoit à l’avenir : 1) l’hivernage (OW), 2) l’hivernage combiné à la température de l’air (OWAT) et 3) la fonction sigmoïde de l’indice linéaire des précipitations et de la température de l’air (SIG). Cela a permis de déterminer les régions offrant les conditions les plus favorables à l’établissement de populations d’Aedes albopictus aux États-Unis et au Canada. Dans cette étude, les modèles les plus extrêmes prédisent aussi que le climat actuel est favorable à Aedes albopictus dans le sud des zones côtières de la Colombie-Britannique, ainsi que dans le sud de l’Ontario, du Québec et des Maritimes. Même les modèles les plus conservateurs prévoient un climat favorable à cette espèce dans des secteurs aussi nordiques que la côte de la Colombie-Britannique, le sud de l’Ontario, du Québec et des Maritimes dès la période 2011 à 2040 (15). Les auteurs suggèrent toutefois que la progression vers le nord pourrait se rendre beaucoup plus loin que ne le prévoient ces modèles dans les zones urbaines et suburbaines qui offrent un refuge contre les extrêmes climatiques, notamment les températures très basses du cœur de l’hiver. La répartition géographique actuelle et projetée des climats favorables à Aedes albopictus est respectivement présentée dans les figures 1 et 2.
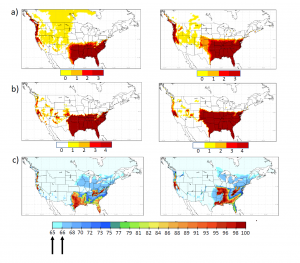
Figure 1 : Adéquation prévue du climat actuel pour Ae. Albopictus : a, b, c présentent les cartes d’adéquation des indicateurs OW, OWAT et SIG pour Aedes albopictus, élaborées à partir de données climatiques recueillies entre 1981 et 2010 (à gauche) et les résultats du modèle CanRCM pour la période allant de 1989 à 2010 (à droite). Pour les indicateurs OW et OWAT, les codes de couleur correspondent au niveau d’adéquation de ces indicateurs (adéquation de faible à haute représentée par le blanc ou le jaune jusqu’à l’orangé et le rouge en fonction des valeurs de la température et des précipitations). Pour l’indicateur SIG, les flèches indiquent les valeurs seuil d’adéquation de 64,64 % et de 66,69 %. Carte utilisée avec l’autorisation de Ogden et al. 2014., Parasites and Vectors, 7:532 (15).
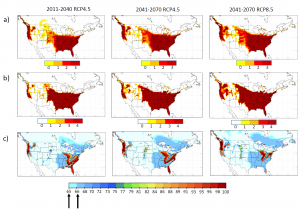
Figure 2: Prédiction de l’adéquation du climat futur pour Ae. albopictus : a, b, c présentent les cartes d’adéquation des indicateurs OW, OWAT et SIG pour Ae. albopictus en fonction des prédictions de changements climatiques couvrant des périodes de 30 ans. Colonne de gauche : 2011 à 2040, milieu et colonne de droite : 2041 à 2070, en fonction des concentrations d’émissions (scénarios RCP4.5 et 8.5). Pour les indicateurs OW et OWAT, les codes de couleur correspondent au niveau d’adéquation de ces indicateurs (adéquation de faible à haute représentée par le blanc ou le jaune jusqu’à l’orangé et le rouge en fonction des valeurs de la température et des précipitations). Pour l’indicateur SIG, les flèches indiquent les valeurs seuil d’adéquation de 64,64 % et de 66,69 %. Carte utilisée avec l’autorisation de Ogden et al. 2014., Parasites and Vectors, 7:532 (15).
Aedes aegypti

Aedes aegypti est le principal vecteur de transmission de la dengue et de la fièvre jaune dans le monde. Considéré comme originaire de l’Afrique, on pense qu’il a été introduit dans les Amériques par le commerce transatlantique des esclaves (20). Actuellement, Aedes aegypti est répandu dans les zones tropicales et subtropicales du monde entier (3) et a tendance à prospérer dans les zones de cohabitation avec les humains, où il utilise des contenants artificiels pour sa reproduction. La femelle s’alimente principalement sur les êtres humains et prend plusieurs repas partiels de sang dans un seul cycle gonotrophique (21), ce qui en fait un vecteur efficace d’agents pathogènes qui s’amplifient facilement chez l’humain, comme la dengue. Sa répartition géographique est limitée par les températures froides, puisqu’on pense qu’une température hivernale de 10 °C représente la limite climatique de sa survie (22). Après avoir été presque éliminé d’au moins 18 pays sur le continent américain entre 1948 et 1962, Aedes aegypti se rétablit autant en Amérique du Sud que du Nord et est associé à la réapparition de la dengue (23).
Khormi et coll. (3) ont décrit une diminution de la distribution géographique des conditions climatiques favorables en 2030, en particulier au Brésil, en Colombie, en Guyane, au Paraguay et au Venezuela, ainsi que dans certaines parties de l’Asie du Sud-Est. On s’attend à ce que le climat demeure favorable dans la plupart des îles du Pacifique et des Caraïbes. Selon cette étude, le stress par le froid semble être le principal facteur limitant la distribution d’Aedes aegypti, dans la mesure où les œufs, les larves et les adultes sont vulnérables aux températures inférieures au point de congélation. Dans les projections à court (2030) comme à long terme (2070), une grande partie de l’Amérique du Nord reste inadaptée à Aedes aegypti, à l’exception de secteurs restreints du Mexique et de la péninsule de la Floride, qui sont marginalement favorables (3). En dépit de ceci, de récentes flambées autochtones de dengue ont été documentées dans le sud du Texas (4) et en Floride (5,24).
Une autre étude réalisée par Eisen et coll. (25) suggère que les changements climatiques présentent un potentiel d’exposition humaine accrue au vecteur Aedes aegypti en augmentant chaque année le nombre de jours d’activité des moustiques femelles et en faisant grimper l’abondance maximale des moustiques. Les chercheurs ont avancé que la hausse des températures à la marge de la distribution géographique pourrait augmenter le taux de survie hivernale des œufs et en favoriser l’éclosion plus hâtive, ce qui prolongerait la saison d’activité. Cependant, parce qu’on ne comprend pas encore très bien les conditions climatiques qui permettent la survie hivernale des œufs et en raison de l’absence de biosurveillance aux limites froides de l’habitat d’Aedes aegypti, il est difficile de déterminer sa distribution géographique actuelle et son potentiel de propagation en Amérique du Nord (25).
Un modèle reposant sur deux scénarios d’émissions de gaz à effet de serre et des projections moyennes globales pour sept variables climatiques représentant les températures saisonnières et extrêmes parallèlement à la disponibilité de l’eau pour la période 2010 à 2039 prédit l’adéquation climatique d’Aedes aegypti (26). Dans les conditions climatiques actuelles, la distribution géographique d’Aedes aegypti était limitée de 35° S à 45° N. Selon le modèle, quel que soit le scénario retenu pour le climat dans l’avenir, on prévoit que la distribution géographique d’Aedes aegypti va s’accroître lors de la période s’échelonnant de 2010 à 2039. On prévoit en particulier que le Centre-Nord et le Nord-Est des États-Unis, entre 36° N et 48° N, présenteront un climat favorable à la propagation d’Aedes aegypti. On prévoit des migrations similaires vers des latitudes plus élevées du nord et du sud autant en Europe qu’en Afrique et dans le centre de l’Australie-Méridionale (26).
Diverses espèces de Culex

Les moustiques du genre Culex (Culex tarsalis, Culex quinquefasciatus, et Culex pipens) sont également des vecteurs préoccupants pour l’Amérique du Nord. Culex tarsalis a été identifié comme le principal vecteur au Canada du virus du Nil occidental (VNO), qui appartient au groupe des flavivirus. Les espèces du genre Culex sont géographiquement réparties partout au Canada et aux États-Unis. Le VNO a été introduit dans l’hémisphère occidental en 1999, lorsqu’une épidémie s’est déclarée dans la ville de New York (27). En 2007, on a rapporté 2 215 cas cliniques confirmés d’infection par le VNO chez les Canadiens, dont 98 % sont survenus dans les provinces des Prairies (28). Contrairement à Aedes albopictus, Culex tarsalis préfère les prairies et les zones consacrées à l’agriculture et à l’élevage, puisqu’il se reproduit dans des étendues d’eau stagnante à forte teneur en matière organique (29), que l’on trouve en abondance dans les Prairies canadiennes. Bien que les humains servent d’hôte « final » au virus du Nil occidental, Culex tarsalis s’alimente autant sur des hôtes aviaires que mammifères, ce qui lui permet d’agir comme un pont entre les espèces. Il est de plus un vecteur compétent des virus moins fréquents de l’encéphalite de Saint-Louis et de l’encéphalite équine de l’Ouest (30).
Une étude canadienne de 2013 prédit les effets du changement climatique sur la répartition de Culex tarsalis et sur la transmission du VNO en se fondant sur trois scénarios d’émissions potentielles à court (2010 à 2039), moyen (2040 à 2069) et long (2070 à 2099) terme (29). Deux des trois scénarios d’émissions à court terme prévoient une augmentation du taux d’infection par le VNO variant entre 24 % et 232 % de hausse mensuelle de la transmission. De surcroît, la saison de transmission s’allonge (dans ce cas-ci, d’août à septembre), un constat que partagent les études réalisées sur Culex quinquefaciatus, un vecteur du VNO présent dans les milieux urbains du sud des États-Unis (31). Les projections à long terme de cette étude sont encore plus sombres, le scénario à long terme prévoyant jusqu’à 27 fois le taux actuel d’infection par le VNO pendant la haute saison. Les auteurs prédisent également l’expansion vers le nord de l’aire de distribution de Culex tarsalis. D’autres études ont montré une augmentation des rapports du VNO en Colombie-Britannique en relation avec des températures estivales élevées, et les changements climatiques projetés pourraient étendre l’habitat favorable à Culex pipiens vers des zones plus septentrionales du Canada (32).
Ressources disponibles
Il existe un certain nombre de ressources en ligne décrivant la distribution géographique actuelle des vecteurs et leur incidence sur l’infection d’humains par des maladies à transmission vectorielle. L’Agence de santé publique du Canada effectue la surveillance des cas de VNO et d’autres maladies à transmission vectorielle que l’on peut consulter à http://healthycanadians.gc.ca (28). Le US Geological Survey dresse une carte interactive des cas de maladies humaines signalés à CDC ArboNET que l’on trouve à l’adresse http://diseasemaps.usgs.gov/mapviewer (33). Walter Reed Biosystematics Unit’s VectorMap (http://vectormap.si.edu) est un portail interactif qui présente les cartes de certaines maladies et les modèles de distribution d’un certain nombre d’espèces d’arthropodes vecteurs de maladies (34). Ces ressources, cependant, sont limitées en ceci qu’elles reposent sur un échantillonnage de convenance plutôt que sur des relevés systématiques.
Pertinence pour la santé publique au Canada
Dans l’ensemble, la documentation actuelle suggère que les changements climatiques se traduiront par une augmentation de la zone géographique favorable aux moustiques vecteurs. Bien qu’il y ait peu de documentation décrivant la distribution prévue au Canada, il existe une tendance à la progression vers le nord qui pourrait être aggravée dans les zones urbaines en raison du refuge qu’elles constituent contre les extrêmes climatiques. L’éventail croissant du vecteur le plus insidieux (autant en termes de virus que d’hôtes animaux), Aedes albopictus, est d’une importance primordiale et préoccupante à relativement court terme. De plus, la tendance à l’augmentation du commerce et du tourisme rendront plus vitale que jamais la sensibilisation des professionnels de la santé publique aux changements de distribution géographique des maladies à transmission vectorielle. Cette sensibilisation accrue aux effets des changements climatiques sur la transmission des maladies à transmission vectorielle contribuera à mieux étayer les stratégies proactives de santé publique.

Tableau 2 : Arbovirus provoquant des maladies dans les Amériques (35)
(Adapté de : CDC)
Documents de référence
(1) Ogden NH, St-Onge L, Barker IK, Brazeau S, Bigras-Poulin M, Charron DF et coll., Cartes des risques d’expansion de l’aire de distribution du vecteur de la maladie de Lyme, Ixodes scapularis, au Canada, aujourd’hui et en tenant compte des changements climatiques. Int J Health Geogr, 22 mai 2008, 7:24-072X-7-24.
(2) Solomon S, Groupe d’experts intergouvernemental sur l’évolution du climat, Groupe de travail I, Climate change 2007: The physical science basis: Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change, Cambridge, New York, Cambridge University Press, 2007.
(3) Khormi HM, Kumar L, « Climate change and the potential global distribution of Aedes aegypti: Spatial modelling using GIS and CLIMEX », Geospat Health, 8 mai 2014 (2), p. 405 à 415.
(4) Brunkard JM, Robles Lopez JL, Ramirez J, Cifuentes E, Rothenberg SJ, Hunsperger EA et coll., « Dengue fever seroprevalence and risk factors, Texas-Mexico border », 2004, Emerg Infect Dis, 13 octobre 2007 (10), p. 1477 à 1483.
(5) Adalja AA, Sell TK, Bouri N, Franco C, « Lessons learned during dengue outbreaks in the United States, 2001-2011 », Emerg Infect Dis, 18 avril 2012 (4), p. 608 à 614.
(6) Lazear HM, Stringer EM, de Silva AM, « The emerging Zika virus epidemic in the Americas: Research priorities », JAMA, 10 mai 2016, 315(18), p. 1945-1946.
(7) Benedict MQ, Levine RS, Hawley WA, Lounibos LP, « Spread of the tiger: Global risk of invasion by the mosquito Aedes albopictus », Vector Borne Zoonotic Dis, printemps 2007, 7(1), p. 76 à 85.
(8) Medlock JM, Hansford KM, Schaffner F, Versteirt V, Hendrickx G, Zeller H et coll., « A review of the invasive mosquitoes in Europe: Ecology, public health risks, and control options », Vector Borne Zoonotic Dis, juin 2012, 12(6), p. 435 à 447.
(9) Grandadam M, Caro V, Plumet S, Thiberge JM, Souares Y, Failloux AB et coll., « Chikungunya virus, southeastern France », Emerg Infect Dis, mai 2011, 17(5), p. 910 à 913.
(10) Rezza G, Nicoletti L, Angelini R, Romi R, Finarelli AC, Panning M et coll., « Infection with chikungunya virus in Italy: an outbreak in a temperate region », Lancet, 1er décembre 2007, 370(9602), p. 1840 à 1846.
(11) World Health Organization, « Chikungunya », 2016, document accessible à l’adresse : http://www.who.int/mediacentre/factsheets/fs327/fr/, document consulté en mai 2016.
(12) Vezzani D, « Review: Artificial container-breeding mosquitoes and cemeteries: A perfect match », Tropl Med & Int Health, 2007, 12(2), p. 299 à 313.
(13) Waldock J, Parham PE, Lelieveld J, Christophides GK, « Climate and human health: The impact of climate change on vector-borne diseases », Paphos, Chypre (17 au 19 octobre 2012), Pathog Glob Health, décembre 2013, 107(8), p. 387 à 392.
(14) Rochlin I, Ninivaggi DV, Hutchinson ML, Farajollahi A, « Climate change and range expansion of the Asian tiger mosquito (Aedes albopictus) in Northeastern USA: Implications for public health practitioners », PLoS One, 2013, 8(4):e60874.
(15) Ogden NH, Milka R, Caminade C, Gachon P, « Recent and projected future climatic suitability of North America for the Asian tiger mosquito Aedes albopictus », Parasit Vectors , 2 décembre 2014, 7:532-014-0532-4.
(16) Fauci AS, Morens DM, « Zika Virus in the Americas—Yet Another Arbovirus Threat », N Engl J Med, 18 février 2016, 374(7), p. 601 à 604.
(17) Bonizzoni M, Gasperi G, Chen X, James AA, « The invasive mosquito species Aedes albopictus: Current knowledge and future perspectives », Trends Parasitol, septembre 2013, 29(9), p. 460 à 468.
(18) Campbell LP, Luther C, Moo-Llanes D, Ramsey JM, Danis-Lozano R, Peterson AT, « Climate change influences on global distributions of dengue and chikungunya virus vectors », Philos Trans R Soc Lond B Biol Sci, 5 avril 2015, 370(1665):10.1098/rstb.2014.0135.
(19) Proestos Y, Christophides GK, Erguler K, Tanarhte M, Waldock J, Lelieveld J, « Present and future projections of habitat suitability of the Asian tiger mosquito, a vector of viral pathogens, from global climate simulation », Philos Trans R Soc Lond B Biol Sci , 5 avril 2015, 370(1665):10.1098/rstb.2013.0554.
(20) Eisen L, Moore CG, « Aedes (Stegomyia) aegypti in the continental United States: A vector at the cool margin of its geographic range », J Med Entomol, mai 2013, 50(3), p. 467 à 478.
(21) Scott TW, Chow E, Strickman D, Kittayapong P, Wirtz RA, Lorenz LH et coll., « Blood-feeding patterns of Aedes aegypti (Diptera: Culicidae) collected in a rural Thai village », J Med Entomol , septembre 1993, 30(5), p. 922 à 927.
(22) Hopp MJ, Foley JA, « Global-scale relationships between climate and the dengue fever vector, Aedes aegypti », Clim Change, 2001, 48(2), p. 441 à 463.
(23) Brathwaite Dick O, San Martin JL, Montoya RH, del Diego J, Zambrano B, Dayan GH, « The history of dengue outbreaks in the Americas », Am J Trop Med Hyg, octobre 2012, 87(4), p. 584 à 593.
(24) Radke EG, Gregory CJ, Kintziger KW, Sauber-Schatz EK, Hunsperger EA, Gallagher GR et coll., « Dengue outbreak in Key West, Florida, USA, 2009 », Emerg Infect Dis, janvier 2012, 18(1), p. 135 à 137.
(25) Eisen L, Monaghan AJ, Lozano-Fuentes S, Steinhoff DF, Hayden MH, Bieringer PE, « The impact of temperature on the bionomics of Aedes (Stegomyia) aegypti, with special reference to the cool geographic range margins », J Med Entomol, mai 2014, 51(3), p. 496 à 516.
(26) Capinha C, Rocha J, Sousa CA, « Macroclimate determines the global range limit of Aedes aegypti », Ecohealth, septembre 2014, 11(3), p. 420 à 428.
(27) Nash D, Mostashari F, Fine A, Miller J, O’Leary D, Murray K et coll., « The outbreak of West Nile virus infection in the New York City area in 1999 », N Engl J Med, 14 juin 2001, 344(24), p. 1807 à 1814.
(28) Agence de la santé publique du Canada, « Surveillance du virus du Nil occidental », 2016, document accessible à l’adresse : http://canadiensensante.gc.ca/diseases-conditions-maladies-affections/disease-maladie/west-nile-nil-occidental/surveillance-fra.php?_ga=1.263738572.119162796.1469118633, document consulté le 12 juillet 2016.
Production of this document has been made possible through a financial contribution from the Public Health Agency of Canada through funding for the National Collaborating Centres for Public Health (NCCPH).
The views expressed herein do not necessarily represent the views of the Public Health Agency of Canada. Information contained in the document may be cited provided that the source is mentioned.
