
Cherchez-vous le document d’orientation de l’ASPC pour les praticiens ?
Mise à jour le 10 octobre 2025
Les points saillants sur les maladies du CCNMI fournissent aux cliniciens et aux praticiens de la santé publique du Canada des analyses à jour des données essentielles sur les maladies infectieuses les plus importantes pour la pratique de la santé publique au pays. Bien qu’il ne s’agisse pas d’un examen exhaustif de la documentation, les informations sont recueillies auprès de sources clés, notamment l’Agence de la santé publique du Canada (ASPC), les Centers for Disease Control and Prevention (CDC) des États-Unis, l’Organisation mondiale de la santé (OMS) et dans des documents évalués par les pairs.
Ce compte rendu a été préparé par Signy Baragar. Les questions, commentaires et suggestions concernant ce compte rendu sont les bienvenus et peuvent être envoyés à nccid@umanitoba.ca.
Questions abordées dans ce numéro :
- Quelles sont les principales caractéristiques de la maladie à streptocoques du groupe A ?
- Où en est la situation concernant les éclosions actuelles de maladies à streptocoques du groupe A ?
- Quel risque les Canadiens ont-ils de contracter une maladie à streptocoques du groupe A à l’heure actuelle?
- Quelles sont les mesures à prendre en cas de suspicion de maladie à streptocoques du groupe A ou de contact ?
Quelles sont les principales caractéristiques de la maladie à streptocoques du groupe A ?
Cause et pathogénie
Une maladie à streptocoques du groupe A (SGA) est causée par la bactérie Streptococcus pyogenes (S. pyogenes) — une bactérie bêta-hémolytique gram-positive qu’on retrouve sur la peau ou dans la gorge. Les cellules sont sphériques, non mobiles, non sporulées et se présentent généralement sous forme de chaînes.
Plusieurs facteurs de virulence contribuent à l’infection humaine à SGA, par la sécrétion ou la libération d’une variété de produits extracellulaires. Parmi les principaux facteurs de virulence, on peut citer la présence de fragments de protéines M qui facilitent la colonisation des SGA, les invasions par les toxines streptolysine S et O, la dissémination bactérienne par la streptokinase, etc.
Le SGA est responsable d’une série d’infections allant de non invasives à invasives. La grande majorité des infections à SGA sont bénignes et non invasives, comme la pharyngite streptococcique (pharyngite aiguë), les infections de la peau et des tissus mous (par exemple, l’impétigo et la cellulite), les fièvres et les éruptions cutanées (par exemple, la scarlatine). Dans de rares cas, S. pyogenes pénètre certaines parties du corps où la bactérie ne se trouve pas normalement, tels que le sang, les tissus profonds ou les poumons. Ces infections sont appelées infections à SGA invasives (SGAi) et peuvent provoquer des maladies graves telles que la fasciite nécrosante (maladie de la chair), le syndrome de choc toxique (SCT) et des infections pulmonaires (la pneumonie, par exemple).
Gouvernement du Canada — Maladies à streptocoque du groupe A (Streptococcus pyogenes)
Brouwer et coll., 2023 — Pathogenèse, épidémiologie et contrôle de l’infection à streptocoque du groupe A (seulement en anglais)
Signes, symptômes et complications
La grande majorité des infections à SGA sont bénignes et non invasives. Les symptômes généraux sont les suivants :
- Maux de gorge douloureux
- Fièvre
- Infections cutanées légères (éruptions, plaies, bosses, cloques)
Cependant, les signes et les symptômes du SGA varient en fonction de la maladie.
Gouvernement du Canada — Maladies à streptocoque du groupe A (Streptococcus pyogenes)
Pharyngite streptococcique
Les symptômes de l’angine streptococcique sont généralement les suivants :
- Gorge rouge et douloureuse
- Douleur lors de la déglutition
- Amygdales rouges et enflammées et/ou taches blanches sur les amygdales
- Ganglions lymphatiques enflés
- Pétéchies (taches rouges sur le palais)
Les symptômes moins fréquents peuvent inclure des maux de tête, des vomissements, des douleurs abdominales et la scarlatine (éruption cutanée) et touchent généralement les enfants.
Les symptômes de la pharyngite streptococcique apparaissent généralement dans les deux à cinq jours suivant l’exposition au SGA et peuvent disparaître en l’espace d’une semaine sans traitement. Un traitement antibiotique est toutefois recommandé pour éviter les manifestations graves et la transmission de la bactérie à d’autres personnes.
Dans de rares cas, la pharyngite streptococcique peut entraîner une fièvre rhumatismale, une maladie rénale, des infections de l’oreille et des sinus, ainsi que des abcès autour des amygdales ou dans le cou.
Compte tenu du chevauchement des symptômes avec d’autres infections virales respiratoires, il est important de noter que la toux, la rhinorrhée (écoulement nasal), l’enrouement et la conjonctivite ne sont pas typiquement observés chez les patients souffrant d’une pharyngite streptococcique ; ils suggèrent fortement une étiologie virale plutôt qu’une pharyngite streptococcique.
ASPC — Fiche de données de sécurité sur les agents pathogènes — Streptococcus pyogenes
Gouvernement du Canada — Maladies à streptocoque du groupe A — Symptômes et traitement
Le Centre américain de contrôle et de prévention des maladies (CDC) — pharyngite streptococcique (seulement en anglais)
Scarlatine
La scarlatine est plus fréquente chez les enfants âgés de 5 à 18 ans. Les personnes atteintes de scarlatine peuvent présenter des éruptions cutanées rouges et blanchâtres granuleuses dont la texture rappelle celle du papier sablé. L’éruption peut d’abord apparaître sous la forme de petites taches plates sur le torse, le cou, l’aisselle et l’aine avant de s’étendre à d’autres parties du corps. En général, la langue est également recouverte d’une pellicule blanc jaunâtre ponctuée de points rouges (papilles) avant de devenir rouge vif et granulée (langue framboisée).
D’autres symptômes fréquents de la scarlatine peuvent se manifester, dont une forte fièvre (38,3 °C ou 101 °F), une gorge très douloureuse et rouge, des douleurs à la déglutition et des ganglions lymphatiques gonflés dans le cou, sensibles au toucher. Les maux de tête, les courbatures, les nausées, les vomissements et les douleurs d’estomac sont moins courants.
Les symptômes de la scarlatine apparaissent généralement de un à cinq jours après le début de la maladie et l’éruption cutanée dure environ sept jours. Lorsque l’éruption disparaît, la peau peut peler pendant plusieurs semaines.
Dans de rares cas, la scarlatine peut entraîner une glomérulonéphrite post-streptococcique (GNPS) et une fièvre rhumatismale.
Agence de la santé publique du Canada — Scarlatine — Fiche de renseignements
CDC — Scarlatine (seulement en anglais)
CDC — Considérations cliniques relatives au streptocoque du groupe A (seulement en anglais)
Fièvre rhumatismale
La fièvre rhumatismale est généralement une réponse immunitaire à une pharyngite streptococcique ou à une scarlatine qui n’a pas été traitée par antibiotiques. Les symptômes sont les suivants :
- Fièvre
- Arthrite (articulations douloureuses et sensibles)
- Douleur thoracique
- Essoufflement
- Rythme cardiaque rapide
- Souffle cardiaque
- Fatigue
- Chorée (mouvements involontaires et aléatoires du corps)
Les symptômes les moins fréquents sont une éruption cutanée rouge, indolore et qui présente une configuration serpigineuse (élévations ou lignes ondulées évoquant des serpents) ou de petits renflements indolores (nodules).
Fondation des maladies du cœur et de l’AVC du Canada — Rhumatisme cardiaque
CDC — Fièvre rhumatismale (seulement en anglais)
Impétigo non bulleux (impétigo contagieux)
L’impétigo non bulleux est le plus fréquent chez les jeunes enfants. Les symptômes comprennent des plaies rouges (apparaissant sous forme de vésicules ou de pustules rouges) qui s’ouvrent et laissent s’écouler du liquide ou du pus. Lorsque le liquide sèche, les plaies se couvrent d’une croûte jaunes ou « couleur miel ». Les démangeaisons sont généralement légères et les lésions guérissent habituellement sans laisser de cicatrices.
Les complications de l’impétigo sont rares, mais peuvent inclure une glomérulonéphrite poststreptococcique (maladie rénale) et une fièvre rhumatismale.
HealthLinkBC — Impétigo (seulement en anglais)
CDC — Impétigo (seulement en anglais)
Maladie mangeuse de chair (fasciite nécrosante)
Le SGA peut être à l’origine de la maladie mangeuse de chair, une affection rare, invasive et potentiellement mortelle. Les symptômes se manifestent par l’apparition soudaine d’une douleur aiguë et d’une enflure sur le site d’une plaie qui se propage rapidement, et par de la fièvre.
D’autres symptômes ultérieurs peuvent comprendre :
- Diarrhée
- Nausées
- Fatigue
- Ulcères, cloques ou taches noires sur la peau
- Vertiges
- Changements de couleur de la peau
La maladie mangeuse de chair peut entraîner la mort des tissus (gangrène), une septicémie, un choc et une défaillance des organes. La mort peut survenir en 12 à 24 heures.
HealthLinkBC — Maladie mangeuse de chair (fasciite nécrosante) (seulement en anglais)
Gouvernement de Manitoba — Fasciite Nécrosante (Maladie mangeuse de chair) (seulement en anglais)
CDC — fasciite nécrosante (seulement en anglais)
Cellulite streptococcique
Les premiers symptômes de la cellulite streptococcique sont la chaleur, la rougeur, l’enflure, la douleur ou la sensibilité d’une zone de la peau. Au fur et à mesure que l’infection se propage, d’autres symptômes peuvent apparaître :
- Frissons
- Fièvre
- Ganglions lymphatiques enflés
Dans de rares cas, la cellulite streptococcique peut entraîner une bactériémie (infection du sang) et des infections des tissus profonds, notamment : thrombophlébite septique (caillots sanguins dans les veines qui provoquent une inflammation), endocardite infectieuse (inflammation des valves cardiaques ou de la paroi interne du cœur), arthrite suppurée (infection bactérienne d’une articulation) et ostéomyélite (infection d’un os).
Gouvernment de l’Alberta — Cellulite (seulement en anglais)
CDC — Cellulite (seulement en anglais)
Syndrome de choc toxique streptococcique (SCTS)
Les premiers symptômes de syndrome de choc toxique streptococcique (SCTS) ressemblent généralement à ceux de la grippe : fièvre, frissons, malaises, vomissements, nausées et des douleurs musculaires. Environ de 24 à 48 heures après l’apparition des symptômes, la pression artérielle d’une personne infectée peut chuter et les symptômes évoluer vers une septicémie avec hypotension (pression artérielle basse), tachycardie (rythme cardiaque plus rapide que la normale), tachypnée (respiration rapide) et une défaillance d’organe.
Centre de contrôle des maladies de la Colombie-Britannique (BCCDC) — Maladie streptococcique invasive du groupe A (seulement en anglais)
CDC — Syndrome de choc toxique streptococcique (seulement en anglais)
CDC — Pour les cliniciens — Syndrome de choc toxique streptococcique (seulement en anglais)
Glomérulonéphrite poststreptococcique (GNPS)
La glomérulonéphrite post-streptococcique (GNPS) est une affection rénale rare qui se manifeste généralement par une réaction immunitaire environ 10 jours après une infection à streptocoque ou une scarlatine, ou 3 semaines après un impétigo. Les symptômes peuvent être les suivants :
- Hématurie macroscopique (sang visible dans l’urine qui donne à l’urine un aspect sombre, rougeâtre ou couleur thé)
- Œdème (enflure), souvent sur le visage, autour des yeux, des mains et des pieds
- Diminution du débit urinaire
- Fatigue ou faiblesse générale
- Hypertension (pression artérielle élevée)
Certaines personnes infectées par la GNPS peuvent ne pas avoir de symptômes ou leurs symptômes peuvent être si légers qu’elles ne pensent pas à consulter un médecin.
CDC — Pour les cliniciens — Post-Streptococcal Glomerulonephritis (seulement en anglais)
CDC — Glomérulonéphrite poststreptococcique (seulement en anglais)
Période d’incubation
La période d’incubation du SGA n’est pas clairement définie et dépend du syndrome clinique.
Les infections à SGA non invasives, telles que la pharyngite streptococcique et la scarlatine, ont généralement une période d’incubation de 2 à 5 jours, à l’exception de l’impétigo, dont la période d’incubation est d’environ 10 jours.
Les périodes d’incubation des infections à SGAi sont généralement de 1 à 3 jours, mais varient en fonction de la maladie. Par exemple, la période d’incubation de l’hypotension due au SCTS varie en fonction du site d’entrée et survient généralement entre 24 et 48 heures après l’apparition des premiers symptômes. La GNPS survient généralement jusqu’à 3 semaines après des infections cutanées à SGA (par exemple, l’impétigo et la cellulite streptococcique).
CDC — Pour cliniciens — Pharyngite streptococcique (seulement en anglais)
CDC — Pour cliniciens — Scarlatine (seulement en anglais)
CDC — Pour cliniciens — Syndrome de choc toxique streptococcique (seulement en anglais)
CDC — Pour cliniciens — Impétigo (seulement en anglais)
CDC — Pour cliniciens — Glomérulonéphrite poststreptococcique (seulement en anglais)
Réservoir et transmission
Le SGA se transmet généralement d’une personne à l’autre par les fluides du nez et de la gorge d’une personne infectée (par la toux ou les éternuements) ou par contact direct avec des plaies infectées sur la peau. Des éclosions de SGA d’origine alimentaire ont également été signalées à la suite de la consommation d’aliments contaminés par S. pyogenes (par exemple, lait non pasteurisé, aliments préparés contenant des œufs).
Il est rare que la transmission du SGA se fasse par contact indirect avec des objets ou par voie aérienne.
Gouvernement du Canada — Maladies à streptocoque du groupe A (Streptococcus pyogenes)
ASPC — Fiche de données de sécurité sur les agents pathogènes — Streptococcus pyogenes
Santé publique Alberta — Lignes directrices pour la prise en charge des maladies — Maladie streptococcique du groupe A, invasive (seulement en anglais)
Diagnostic de laboratoire
Le diagnostic de SGA est généralement établi en isolant les SGA d’un site normalement stérile (par exemple, le sang, le tissu d’une plaie profonde, le liquide céphalorachidien). Toutefois, les diagnostics varient en fonction du syndrome clinique.
Tous les laboratoires doivent soumettre les isolats de SGA confirmés au National Centre for Streptococcus (NCS) en Alberta pour le sérotypage de la protéine M.
Santé publique Alberta — Lignes directrices pour la prise en charge des maladies — Maladie streptococcique du groupe A, invasive (seulement en anglais)
Pharyngite streptococcique et scarlatine
Une culture de gorge est le test de référence pour la pharyngite à streptocoque et la scarlatine du groupe A. Un test antigénique rapide peut également être utilisé. Il présente une spécificité élevée pour le streptocoque du groupe A ; ses sensibilités, toutefois, varient par rapport aux tests de culture de gorge.
CDC — Pour cliniciens — Pharyngite streptococcique (seulement en anglais)
CDC — Pour cliniciens — Scarlatine (seulement en anglais)
Fièvre rhumatismale
Il n’existe pas de test diagnostique spécifique pour la fièvre rhumatismale. En raison du large éventail de symptômes, les diagnostics différentiels de la fièvre rhumatismale aiguë peuvent comprendre le lupus érythémateux, la polyarthrite rhumatoïde, l’arthrite septique, l’arthrite juvénile idiopathique et d’autres pathologies.
CDC — Pour Cliniciens — Fièvre rhumatismale (seulement en anglais)
Impétigo non bulleux
Les tests de laboratoire pour l’impétigo non bulleux ne sont ni nécessaires ni réalisés en pratique clinique. Pour poser un diagnostic, les médecins examinent généralement les lésions au cours d’un examen physique. Toutefois, celui-ci ne permet que difficilement de différencier hors de tout doute l’impétigo non bulleux streptococcique de l’impétigo non bulleux staphylococcique.
CDC — Pour cliniciens — Impétigo (seulement en anglais)
CDC — Impétigo (seulement en anglais)
Maladie mangeuse de chair
La maladie mangeuse de chair fait l’objet d’un diagnostic clinique fondé sur un fort soupçon pour les patients présentant une douleur sévère et profonde à l’endroit d’une plaie. Toutefois, en présence de symptômes non spécifiques (fièvre inexpliquée, douleur, œdème), il peut être difficile de distinguer la maladie mangeuse de chair de la cellulite à streptocoque.
Les tests de laboratoire suivants peuvent dépister la maladie mangeuse de chair :
- Formule sanguine complète (FSC), telle que leucocytose
- Plaquettes (thrombocytopénie)
- Électrolytes
- Azote uréique sanguin (BUN)
- Taux de filtration glomérulaire (TFG)
- Protéine C-réactive (CRP)
- Rapport normalisé international (INR)
- Tests de la fonction hépatique (LFT)
- Électrocardiogramme (ECG)
La coloration de Gram peut aussi permettre de déterminer si la maladie est causée par le SGA.
Soins d’urgence en Colombie-Britannique — Résumé clinique d’urgence au point de service — Syndrome de choc toxique — Diagnostic (seulement en anglais)
BC Cancer — Tableau d’interprétation des résultats d’analyses de laboratoire (seulement en anglais)
CDC — Pour cliniciens — Fasciite nécrosante de type II (seulement en anglais)
Cellulite streptococcique
La cellulite streptococcique est habituellement diagnostiquée cliniquement. Il n’est généralement pas nécessaire de procéder à des analyses de sang ou à d’autres examens de laboratoire.
CDC — Pour cliniciens — Cellulite (seulement en anglais)
Syndrome de choc toxique streptococcique (SCTS)
Aux premiers stades du STCS, le diagnostic différentiel peut être étendu et couvrir le choc toxique staphylococcique ou d’autres infections virales ou bactériennes. Les examens de laboratoire peuvent comprendre des hémocultures (qui sont souvent, mais pas toujours, positives), des analyses de sang et des analyses d’urine.
Soins d’urgence en Colombie-Britannique — Résumé clinique d’urgence au point de service — Syndrome de choc toxique — Diagnostic (seulement en anglais)
CDC — Pour cliniciens — Syndrome de choc toxique streptococcique (seulement en anglais)
John Hopkins Medicine — Syndrome de choc toxique streptococcique (SCTS) (seulement en anglais)
Glomérulonéphrite poststreptococcique (GNPS)
Un diagnostic de glomérulonéphrite post-streptococcique requiert la preuve d’une infection à SGA antérieure. Une telle preuve peut être apportée par un taux élevé d’anticorps streptococciques et par l’isolement du streptocoque dans des lésions cutanées ou dans la gorge.
CDC — Pour cliniciens — Glomérulonéphrite poststreptococcique (seulement en anglais)
Prévention et contrôle
L’un des meilleurs moyens de se protéger contre le SGA est de se laver les mains après avoir toussé et éternué, et avant de manger et de préparer des aliments.
Pour réduire la propagation de SGA par les gouttelettes respiratoires provenant du nez ou de la gorge, il convient également de respecter une bonne hygiène et étiquette respiratoire (toux). Cela signifie notamment de :
- tousser ou éternuer dans un mouchoir en papier et le jeter après usage ;
- tousser ou éternuer dans le pli du bras, et non dans les mains, lorsqu’il n’y a pas de mouchoirs en papier ;
- se laver souvent les mains à l’eau et au savon, ou utiliser un désinfectant pour les mains, avant de se toucher le visage (yeux, nez et bouche).
Les lésions cutanées, telles que les plaies ou les coupures, peuvent permettre à S. pyogenes de pénétrer dans l’organisme. C’est pourquoi il est également important de nettoyer toutes les lésions cutanées et de surveiller les signes d’infection (enflure, rougeur, douleur, écoulement).
Gouvernement du Canada — Maladies à streptocoque du groupe A : Risques et prévention
BCCDC — Maladie streptococcique invasive du groupe A (seulement en anglais)
Vaccination
Il n’existe actuellement aucun vaccin pour la prévention des infections à SGA ; cependant, des plans mondiaux pour le premier vaccin contre le SGA sont en cours d’élaboration.
En 2018, l’Organisation mondiale de la Santé a publié la feuille de route pour la recherche et le développement (R&D) de vaccins contre le SGA et les caractéristiques préférées du produit (PPC) pour le développement du premier vaccin contre le SGA. Les avancées réalisées dans ce domaine sont exposées dans la présentation de 2022, WHO expert review of Group A Streptococcus vaccines. Conformément à la mission de l’OMS visant à développer des vaccins contre le SGA, le SAVAC (Strep A Vaccine Global Consortium) a été créé afin de faciliter davantage le développement de vaccins contre le SGA. Le rapport du forum SAVAC de mai 2024 résume les principaux obstacles à l’investissement industriel dans la R&D sur les vaccins contre le streptocoque A, ainsi que les recommandations pour surmonter ces obstacles. Le forum a également examiné les derniers progrès réalisés dans le développement de nouveaux vaccins contre le SGA, tels que décrits par Walkinshaw et coll. (2023) Il s’agit notamment de quatre candidats basés sur la protéine M et de quatre candidats conçus autour d’antigènes non liés à la protéine M. Les tableaux 1 et 2 répertorient les huit candidats vaccins, leurs développeurs et leur stade de développement en février 2023 (date de publication de l’article).
Tableau 1. Développements de vaccins contre S. pyogenes à base de protéine M
| Candidat | Développeur | Phase de développement actuelle | Antigènes |
| StreptAnova (30 valents) | Université du Tennessee et Vaxent | Phase 1a achevée en 2020 | Quatre sous-unités protéiques composant les régions N-terminales des protéines M provenant de 30 sérotypes de S. pyogenes |
| J8/S2 combivax | Université Griffith et Université de l’Alberta | Phase 1a en cours | Peptide J8 provenant de l’extrémité C-terminale de la protéine M combiné à un épitope de cellule B de 20 mer (K4S2) provenant de SpyCEP |
| Combivax P* 17/S 2 | Université Griffith et Université de l’Alberta | Phase 1a en cours | Peptide P* 17 provenant de l’extrémité C-terminale de la protéine M combiné à un épitope de cellule B de 20 mer (K4S2) provenant de SpyCEP |
| StreptInCor | Université de São Paulo | Préclinique | Peptide de 55 acides aminés provenant des régions conservées (C2 et C3) de la protéine M5 |
Remarque. Le tableau a été adapté à partir de Walkinshaw et coll. (2023) le 10 octobre 2025.
Tableau 2. Développements de vaccins contre S. pyogenes sans protéine M
| Candidat | Développeur | Phase de développement actuelle | Antigènes |
| Combo 4 | GlaxoSmithKline et GVGH | Préclinique | Protéines recombinantes SpyCEP, SLO et SpyAD et GAC natif conjugué à la protéine porteuse CRM197 |
| VAX-A1 | Vaxcyte | Préclinique | Protéines recombinantes SLO et SCPA et GAC modifié (polyrhamnose) conjugué à la protéine porteuse spécifique à la maladie SpyAD |
| Combo 5 | Université du Queensland | Préclinique | Facteur déclencheur (TF), versions inactivées de l’arginine déiminase (ADI), SLO, SpyCEP et SCPA |
| TeeVax | Université d’ Auckland | Préclinique | Domaines multiples de l’antigène T provenant du pilus de la majorité des souches de S. pyogenes |
Remarque. SpyCEP protéase streptococcique de l’interleukine -8, SLO streptolysine O, SpyAD protéine putative d’exclusion de surface, Spy0269, GAC glucide du groupe A, SCPA peptidase streptococcique C5a. Le tableau a été adapté à partir de Walkinshaw et coll. (2023) le 10 octobre 2025.
Les candidats vaccins contre le SGA sont décrits plus en détail dans Walkinshaw et coll. (2023)
Le dernier événement consacré au développement du vaccin contre le SGA a été organisé le 20 mai 2025 lors de la 78e Assemblée mondiale de la Santé par le International Vaccine Institute (IVI). Un résumé des informations présentées lors de cet événement est disponible dans son rapport de juillet 2025.
Pour plus d’informations sur le SAVAC et sa mission visant à promouvoir l’accès mondial aux vaccins contre le SGA, consultez le court documentaire 2024 de l’IVI ci-dessous (en anglais seulement).
ASPC — Fiche de données de sécurité sur les agents pathogènes — Streptococcus pyogenes
Présentation de l’OMS — WHO expert review of Group A Streptococcus vaccines, September 30, 2022
Strep A Vaccine Global Consortium (SAVAC) — À propos
Walkinshaw et coll. 2023 — The Streptococcus pyogenes vaccine landscape
Traitement
Le traitement varie en fonction du type d’infection à SGA. En l’absence de vaccin contre le SGA, la plupart des maladies à SGA sont traitées par antibiotiques (pénicilline, macrolide ou céphalosporine). Toutefois, des stratégies de gestion de la résistance aux antimicrobiens (RAM) devraient être envisagées pour réduire l’usage inutile d’antibiotiques.Par exemple, selon Choisir avec soin Canada, lors du traitement d’une pharyngite du groupe A, il est conseillé de n’utiliser des antibiotiques qu’en cas de pharyngite bactérienne confirmée et de retarder l’administration d’antibiotiques dans l’attente des résultats d’une culture de gorge. Pour plus d’information sur l’utilisation judicieuse des antibiotiques, consultez le site Choisir avec soin Canada.
ASPC — Fiche de données de sécurité sur les agents pathogènes — Streptococcus pyogenes
Épidémiologie
Général
Les maladies à SGAi sont une cause mondiale de morbidité et de mortalité, mais elles sont plus répandues dans les populations vivant dans des conditions de surpeuplement ou dans des régions socio-économiquement désavantagées. Dans le monde, les maladies à SGAi sont responsables de plus de 500 000 décès par an.
Après la pandémie de COVID-19, plusieurs pays ont connu une augmentation du nombre de maladies à SGAi. En décembre 2022, l’Organisation mondiale de la santé a signalé une augmentation du nombre de cas de maladies à SGAi et de décès en Europe (notamment en France, aux Pays-Bas, au Royaume-Uni, en Irlande et en Suède). Toujours en décembre 2022, les Centres américains de contrôle et de prévention des maladies (CDC) ont émis un avis sanitaire concernant une augmentation des cas de maladie SGAi chez les enfants.
ASPC — Fiche de données de sécurité sur les agents pathogènes — Streptococcus pyogenes
OMS, décembre 2022, communiqué de presse — Augmentation des infections invasives à streptocoques du groupe A chez les enfants en Europe, y compris des décès (seulement en anglais)
CDC, décembre 2022, Réseau d’alerte sanitaire — Augmentation des infections invasives à streptocoques du groupe A chez les enfants (seulement en anglais)
Canada
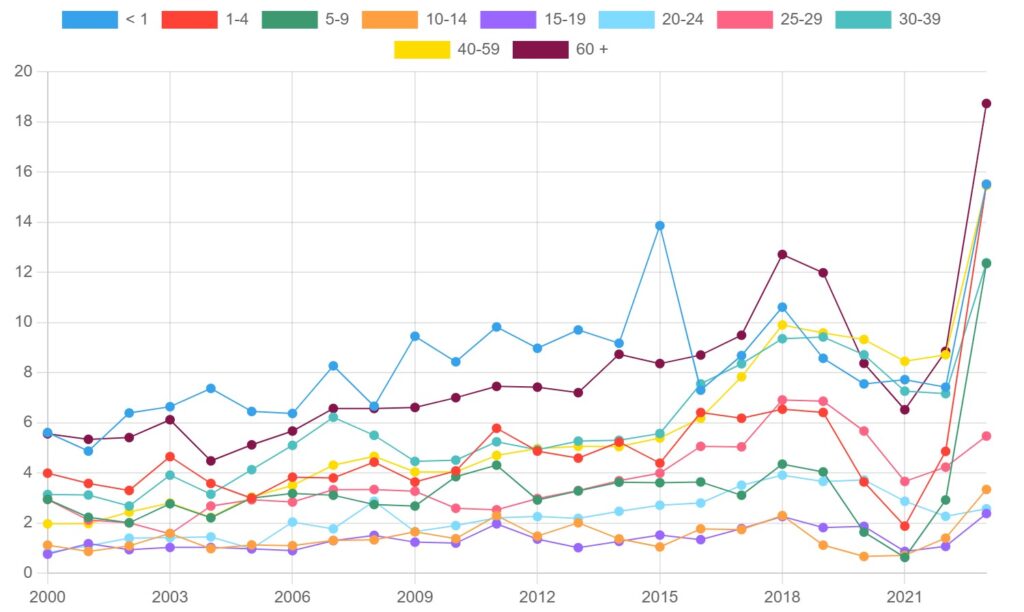
Le SGAi est endémique au Canada, le nombre moyen de cas étant en augmentation depuis 2000 (figures 1 et 2).
Figure 1. Taux de SGAi pour 100 000 habitants au Canada, 2000-2023
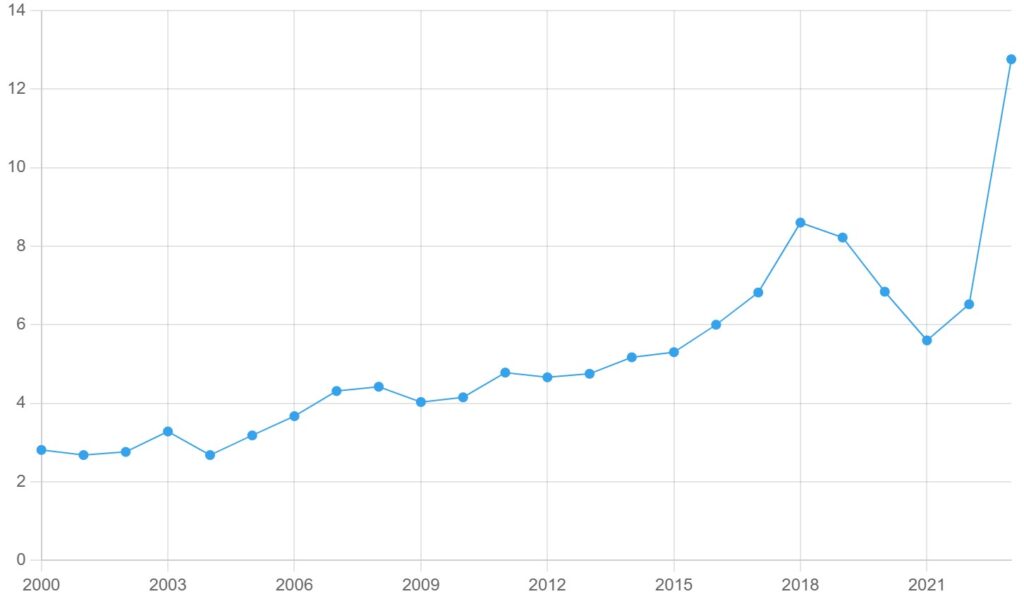
Figure 2. Taux de SGAi pour 100 000 habitants au Canada, par groupe d’âge, 2000-2023
Les données nationales sur les SGAi du Système canadien de surveillance des maladies à déclaration obligatoire (SCSMDO) sont disponibles jusqu’en 2023. En 2023, il y a eu 4 929 cas de SGAi au Canada (12,76 cas de SGAi pour 100 000 habitants), un nombre record pour le pays. Le pic précédent avait été atteint en 2019, avec environ 3 200 cas.
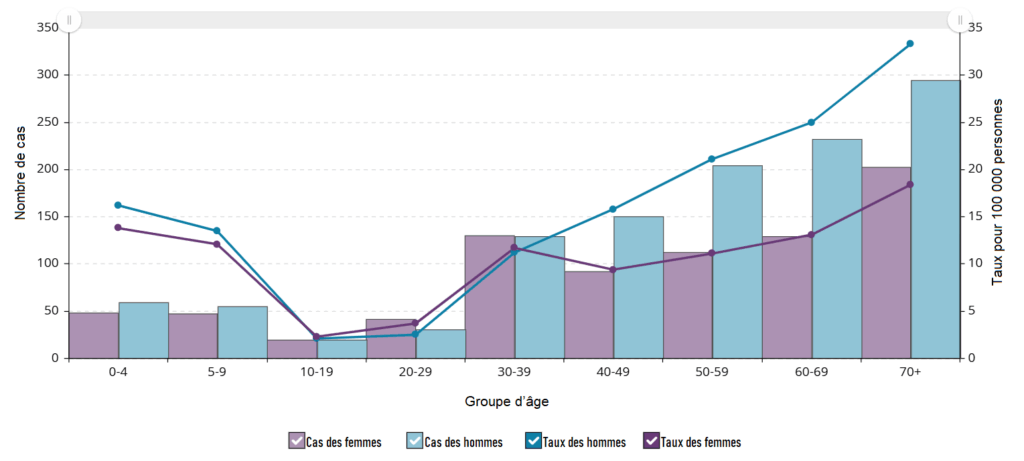
Les groupes d’âge les plus touchés par les SGAi en 2023 étaient les adultes de plus de 60 ans (18,73 cas pour 100 000 habitants), suivis des enfants de moins de 4 ans (15,51 cas pour 100 000 habitants) et des adultes âgés de 40 à 59 ans (15,46 cas pour 100 000 habitants). Le tableau 3 présente les taux d’incidence des SGAi (pour 100 000 habitants) et le nombre de cas pour chaque groupe d’âge, classés du plus élevé au plus faible, pour l’année 2023.
Tableau 3. Taux d’incidence et nombre de cas de SGAi au Canada par groupe d’âge en 2023, classés par ordre décroissant du taux d’incidence
| Cas de SGAi pour 100 000 habitants | Nombre de cas signalés | Tranche d’âge (années) |
| 18,73 | 1856 | Plus de 60 |
| 15,51 | 278 | 0 à 4 |
| 15,46 | 1511 | 40 à 59 |
| 12,38 | 693 | 30 à 39 |
| 12,35 | 251 | 5 à 9 |
| 5,47 | 153 | 25 à 29 |
| 3,34 | 70 | 10 à 14 |
| 2,57 | 64 | 20 à 24 |
| 2, 38 | 51 | 15 à 19 |
Données provinciales et territoriales
Les taux et le nombre de cas de SGAi les plus récents pour le Manitoba, l’Alberta, la Colombie-Britannique et l’Ontario sont disponibles sur les sites Web ou les tableaux de bord provinciaux respectifs. Le tableau 4 présente les taux d’incidence et le nombre de cas de SGAi pour le Manitoba, l’Alberta, l’Ontario et la Colombie-Britannique de 2022 à 2024.
Tableau 4. Taux de SGAi pour 100 000 habitants et nombre de cas pour le Manitoba, l’Alberta, l’Ontario et la Colombie-Britannique, 2022-2024
| 2022 | 2023 | 2024 | ||||
| Province | Taux de SGAi pour 100 000 habitants | Nombre de cas signalés | Taux de SGAi pour 100 000 habitants | Nombre de cas signalés | Taux de SGAi pour 100 000 habitants | Nombre de cas signalés |
| Manitoba | 11,8 | 168 | 19,2 | 279 | 21,9 | 326 |
| Alberta | 9,62 | 434 | 16,40 | 6,1 | S. O. | S. O. |
| Colombie-Britannique | 8,7 | 464 | 10,9 | 600 | S. O. | S. O. |
| Ontario | 6,1 | 922 | 12,8 | 1997 | S. O. | S. O. |
Selon la littérature la plus récente sur la surveillance des SGAi au Canada par Golden et coll. (2024), les provinces et régions du Canada ont soumis le nombre suivant d’isolats bactériens de SGAi au Laboratoire national de microbiologie (LNM) de Winnipeg pour analyse en 2022 :
- Manitoba : 201 isolats
- Alberta : 522 isolats
- Colombie-Britannique : 425 isolats
- Ontario : 905 isolats
- Québec : 365 isolats
- Saskatchewan : 121 isolats
- Canada atlantique (Nouveau-Brunswick, Île-du-Prince-Édouard, Nouvelle-Écosse et Terre-Neuve-et-Labrador) : 80 isolats
- Nord du Canada (Yukon, Territoires du Nord-Ouest et Nunavut) : 11 isolats
Système canadien de surveillance des maladies à déclaration obligatoire — Streptocoques du groupe A
Gouvernement du Canada — Maladies à streptocoques du groupe A : Pour les professionnels de la santé
Santé Manitoba — Streptocoque du groupe A (SGA)
Application interactive de données de santé du gouvernement de l’Alberta — SGAi (seulement en anglais)
Centre de contrôle des maladies de la Colombie-Britannique — Tableau de bord des maladies transmissibles (seulement en anglais)
Centre de contrôle des maladies de la Colombie-Britannique — Infections from invasive group A streptococcal bacteria remain higher than usual among children in B.C., 18 janvier 2024 (seulement en anglais)
Santé publique Ontario — Streptocoque du groupe A invasif (SGAi)
Golden et coll., 2024. Surveillance des infections invasives à streptocoques du groupe A au Canada, 2021-2022 (seulement en anglais)
Manitoba
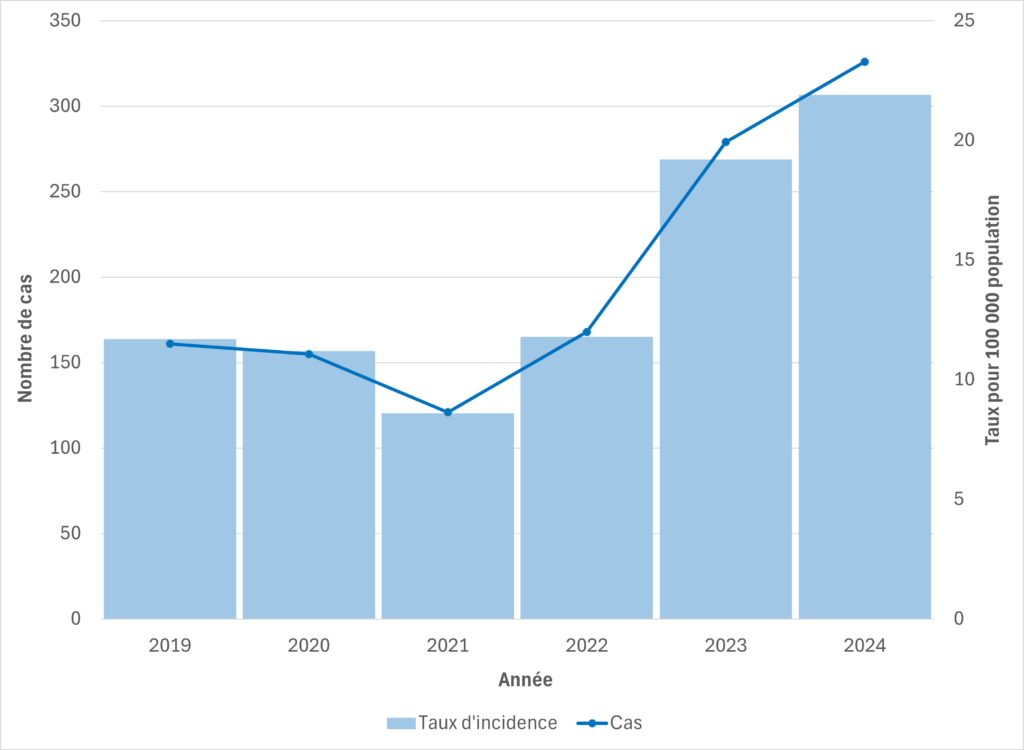
Figure 3. Cas de SGAi et taux d’incidence pour 100 000 habitants au Manitoba, 2019-2024
Alberta
Figure 4. Cas de SGAi et taux d’incidence pour 100 000 habitants en Alberta, 2014-2023
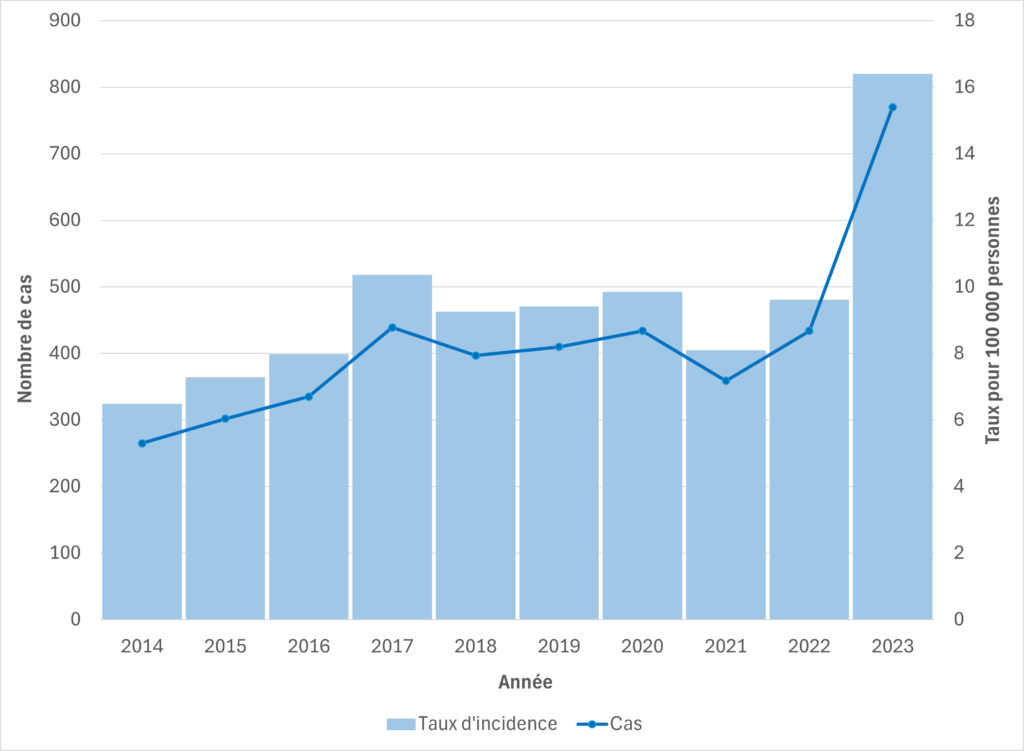
Figure 5. Cas de SGAi et taux d’incidence pour 100 000 habitants en Alberta, par groupe d’âge et par sexe, 2023
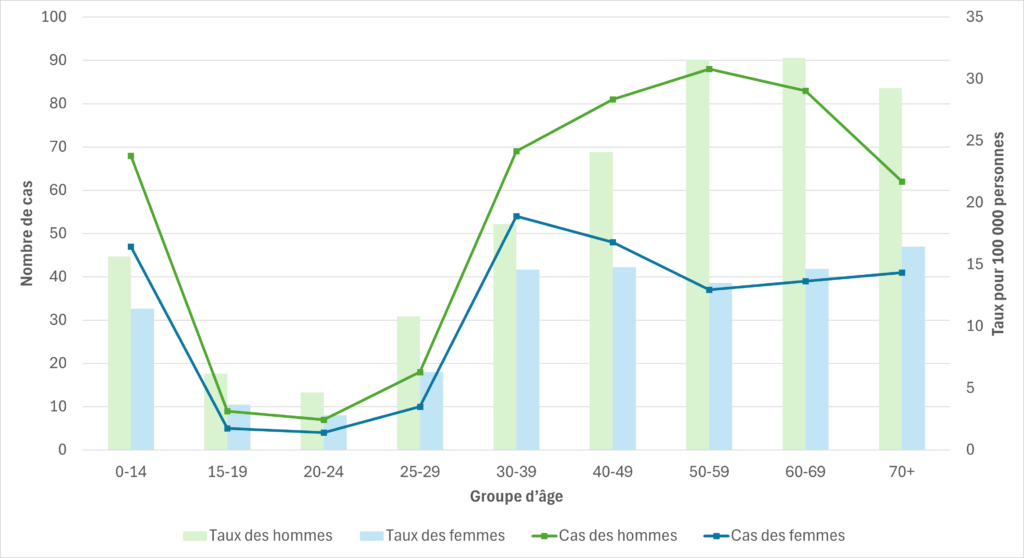
Colombie-Britannique
Figure 6. Cas de SGAi et taux d’incidence pour 100 000 habitants en Colombie-Britannique, 2014-2023
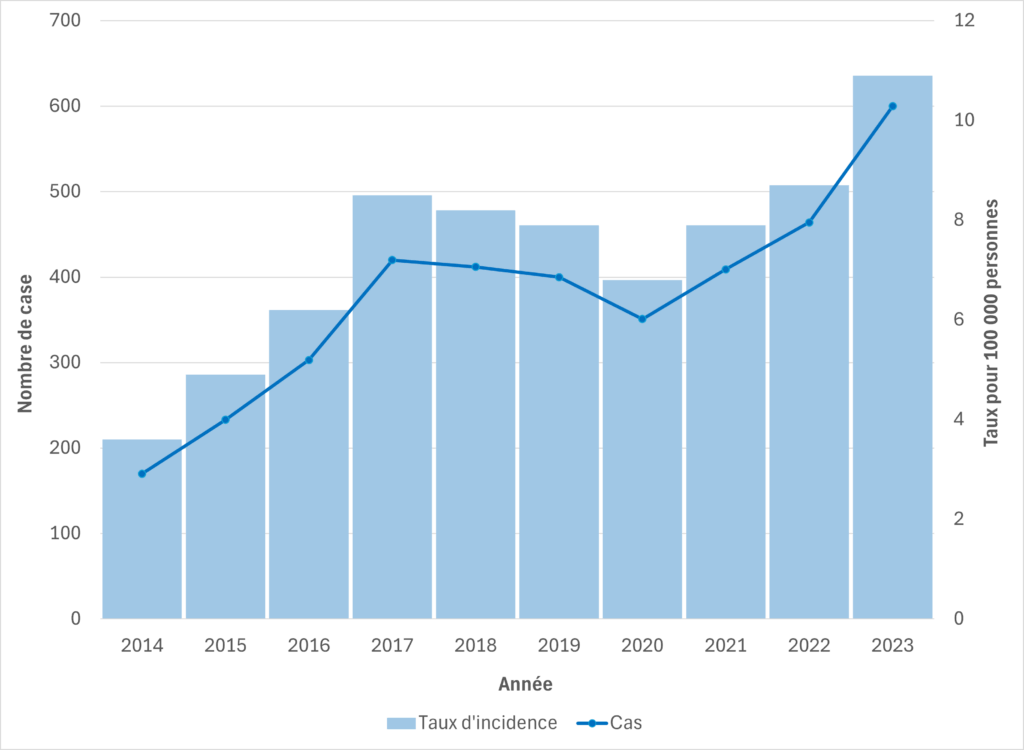
Figure 7. Cas de SGAi et taux d’incidence pour 100 000 habitants en Colombie-Britannique, par groupe d’âge et par sexe, 2023
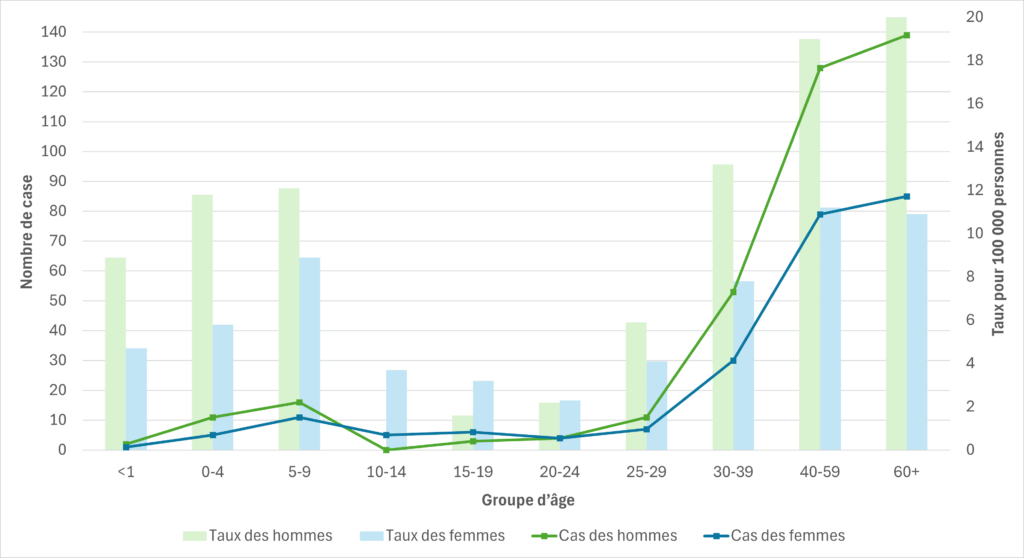
Les données pour chaque région sanitaire de la Colombie-Britannique sont disponibles sur le tableau de bord des maladies transmissibles du Centre de contrôle des maladies de la Colombie-Britannique.
Ontario
Figure 8. Cas de SGAi et taux d’incidence pour 100 000 habitants en Ontario, 2014-2023
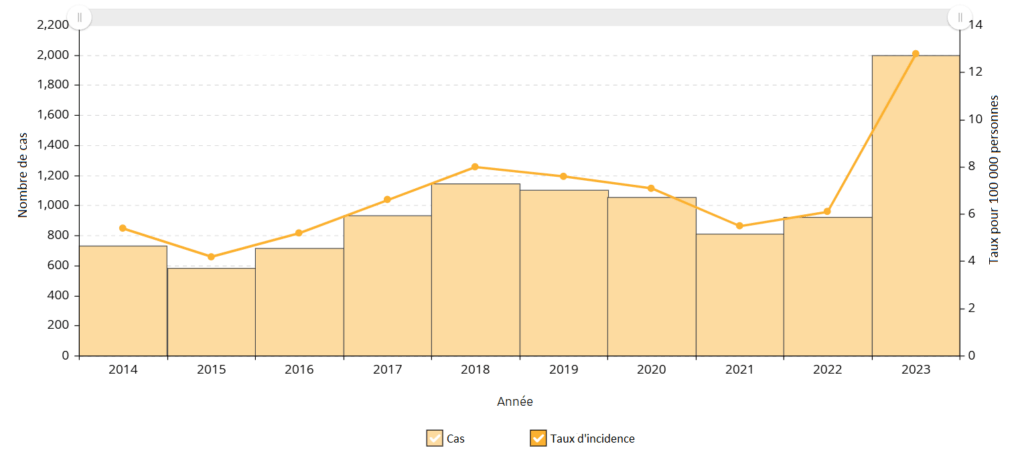
Figure 9. Cas de SGAi et taux d’incidence pour 100 000 habitants en Ontario, par groupe d’âge et par sexe, 2023
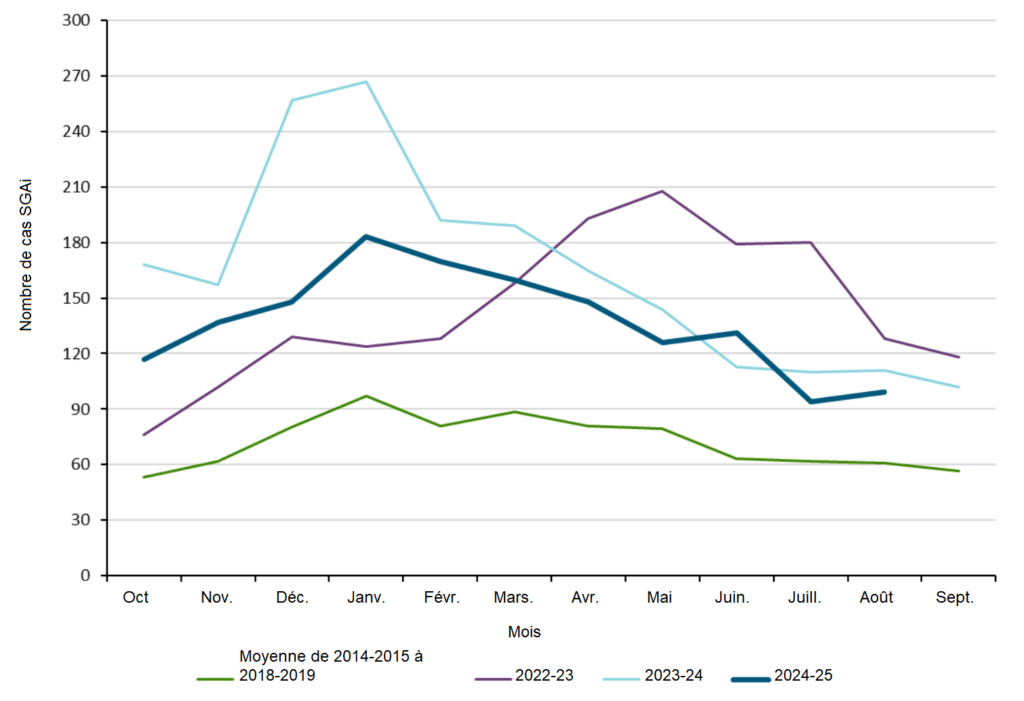
En Ontario, le nombre de cas de SGAi et le taux d’incidence signalés entre le 1er octobre 2024 et le 30 août 2025 ont été en moyenne inférieurs à ceux de la saison 2023-2024. Toutefois, le nombre total de cas pour la période 2024-2025 était supérieur à la moyenne des cinq saisons prépandémiques (figure 10).
Figure 10. Nombre de cas confirmés de SGAi en Ontario pour la saison 2024-2025 (du 1er octobre 2024 au 31 août 2025) par rapport aux saisons prépandémiques (du 1er octobre 2014 au 30 septembre 2019).
Santé Manitoba — Streptocoque du groupe A (SGA)
Application interactive de données de santé du gouvernement de l’Alberta — SGAi
Centre de contrôle des maladies de la Colombie-Britannique — Tableau de bord des maladies transmissibles
Santé publique Ontario — Streptocoque du groupe A invasif (SGAi)
États-Unis
Les données sur les SGAi provenant du Active Bacterial Core surveillance (ABCs) Tableau de bord du CDC sont disponibles jusqu’en 2023.
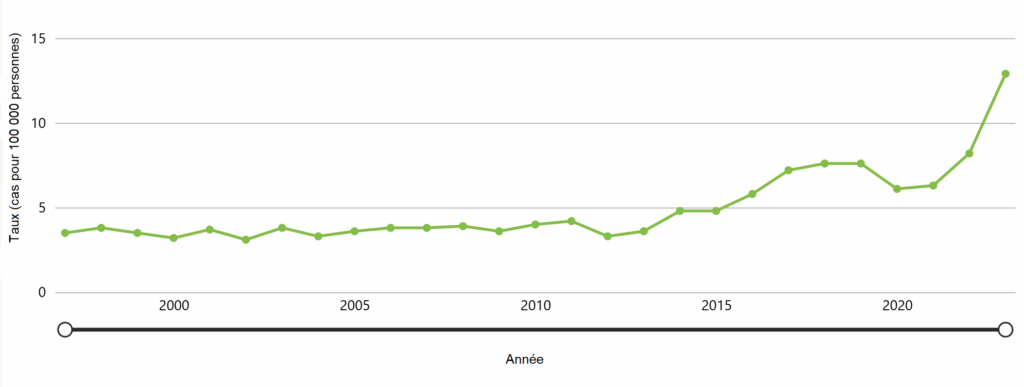
Le nombre moyen de cas de SGAi a augmenté aux États-Unis au cours de la dernière décennie, les données de 2023 indiquant un pic sur 20 ans du nombre d’infections graves causées par le SGAi. En 2023, les États-Unis ont signalé 43 100 cas de SGAi (12,9 cas pour 100 000 habitants).
Figure 11. Taux pour 100 000 cas signalés de SGAi aux États-Unis entre 1997 et 2023
CDC — Group A Streptococcal (GAS) Disease — Surveillance
CDC — Bact Facts Interactive — Tableau de bord des données — Streptocoque du groupe A (SGA)
Que se passe-t-il avec les épidémies actuelles de streptocoque invasif du groupe A ?
Les données sur les SGAi au-delà de 2023 sont accessibles au public pour le Manitoba et l’Ontario.
Au Manitoba, le nombre de cas et de décès liés aux SGAi a augmenté en 2024 par rapport à 2023, avec 326 cas (21,9 cas pour 100 000 habitants) et 27 décès signalés en 2024, contre 279 cas (19,2 cas pour 100 000 habitants) et 21 décès en 2023. Entre le 1er janvier et le 8 juillet 2025, 127 cas (8,5 cas pour 100 000 habitants) et 9 décès ont été signalés dans la province.
En Ontario, le nombre de cas et de décès liés aux SGAi a été moins élevé pendant la saison 2024-2025 (du 1er octobre 2024 au 31 août 2025) que pendant la saison 2023-2024. En 2024-2025, 1 513 cas (9,3 cas pour 100 000 habitants) et 158 décès ont été signalés, contre 1 873 cas (11,7 cas pour 100 000 habitants) et 221 décès en 2023-2024. Cela représente une réduction de 20,5 % du taux d’incidence entre les saisons 2024-2025 et 2023-2024.
Santé Manitoba — Streptocoque du groupe A (SGA)
Streptocoque du groupe A invasif (SGAi) en Ontario : du 1er octobre 2024 au 31 août 2025.
Quel risque les Canadiens ont-ils de contracter une maladie à streptocoques du groupe A à l’heure actuelle?
Le SGA se transmettant généralement de personne à personne par la toux ou les éternuements, les taux de transmission sont plus élevés dans les milieux sociaux surpeuplés et/ou fermés, tels que les écoles, les garderies, les hôpitaux, les refuges pour sans-abri et les maisons de retraite.
Les risques d’infection à SGA ont également été associés aux facteurs suivants :
- Affections chroniques sous-jacentes, notamment :
- diabète
- maladies pulmonaires
- maladies du foie
- maladies cardiaques
- Affaiblissement du système immunitaire causé par :
- traitements anticancéreux (radiothérapie, chimiothérapie)
- maladie (infection par le VIH, sida)
- médicaments antirejet après une transplantation d’organe ou de moelle osseuse
- Lésions cutanées, y compris les lésions de la peau :
- blessures
- coupures
- brûlures
- plaies ouvertes
- infection causée par la varicelle
- Abus de substances, y compris l’utilisation de drogues injectables
- Contact étroit récent avec une personne infectée par le SGA
En outre, plusieurs études ont examiné les groupes de population susceptibles de présenter un risque plus élevé d’infection à SGA. La littérature distingue d’autres groupes à risque :
- Les personnes enceintes, en état de post-partum et les nouveau-nés
- Les enfants de moins de 15 ans
- Les personnes s’identifiant comme étant de sexe masculin
- Les personnes âgées
- Les personnes vivant dans de mauvaises conditions de logement (par exemple, humidité, mauvaise ventilation, mauvaise température).
- Les personnes exposées :
- à la fumée de tabac
- à des insectes piqueurs
- à des lésions cutanées
Gouvernement du Canada — Maladies à streptocoque du groupe A : Pour les professionnels de la santé
Avire et coll., 2021. Une revue sur Streptococcus pyogenes : facteurs de risque pour la santé publique, prévention et contrôle (seulement en anglais)
Quelles sont les mesures à prendre en cas de suspicion de maladie à streptocoques du groupe A ou de contact ?
Les personnes soupçonnées d’être atteintes d’une infection à SGA doivent immédiatement consulter un médecin pour être testées et traitées.
Les contacts proches avec les personnes atteintes d’une infection à SGAi devraient surveiller l’apparition de symptômes et consulter un médecin s’ils présentent des manifestations cliniques. Les contacts rapprochés peuvent être définis comme suit :
- Contacts familiaux d’une personne atteinte d’une infection à SGA qui ont passé avec le elle au moins 4 heures par jour en moyenne au cours des 7 derniers jours ou 20 heures par semaine.
- Personnes ne faisant pas partie du ménage qui ont dormi dans le même lit que la personne atteinte d’une infection à SGA ou ont eu des relations sexuelles avec le elle
- Personnes qui ont eu des contacts muqueux directs avec les sécrétions orales ou nasales d’une personne atteinte d’une infection à SGA (p. ex., bouche-à-bouche, baiser bouche ouverte) ou un contact direct non protégé avec une lésion cutanée ouverte chez la personne atteinte d’une infection à SGA
- Utilisateurs de drogues par injection qui ont partagé des aiguilles avec la personne atteinte d’une infection à SGA
Définition de cas :
Cas confirmé
- Isolement de Streptococcus pyogenes du groupe A ou détection de l’acide désoxyribonucléique (ADN) par un test d’amplification de l’acide nucléique (TAAN) à partir d’un site normalement stérile (sang, liquide céphalorachidien, liquide pleural, liquide péritonéal, liquide péricardique, os ou liquide articulaire, ou échantillons prélevés au cours d’une intervention chirurgicale) avec ou sans preuve d’une maladie invasive grave.
Cas probable
- Isolement d’un streptocoque du groupe A à partir d’un site non stérile (par exemple, la peau) en l’absence d’une autre étiologie identifiée, avec des signes de maladie invasive grave.
Ontario Ministry of Health January 2024 Infectious Disease Protocol — Appendix 1: Case Definitions and Disease-Specific Information: Group A Streptococcal Disease, Invasive (iGAS) (seulement en anglais)
Identification et déclaration :
Au Canada, les cas confirmés de maladie à SGAi doivent être obligatoirement déclarés depuis janvier 2000. Les provinces et les territoires sont chargés de signaler les cas confirmés de maladie à SGAi à l’ASPC par l’intermédiaire du Système canadien de surveillance des maladies à déclaration obligatoire (SCSDEO). La surveillance est assurée par la notification systématique des cas au niveau fédéral.
Les laboratoires de santé publique des provinces et des territoires peuvent, sur demande, bénéficier de l’aide du Laboratoire national de microbiologie (LNM) pour les enquêtes sur les éclosions d’infections à SGAi.
Golden et coll., 2022. Surveillance des streptocoques invasifs du groupe A (SGAi) au Canada, 2020 (anglais seulement)
