1. Introduction
La maladie de Lyme est l’infection à transmission vectorielle la plus commune en Amérique du Nord. Elle est endémique au Canada depuis le début des années 1980, quoique sa présence ait été limitée avant 1997.1 Mais depuis 17 ans, la maladie s’est propagée au Canada et est actuellement endémique dans certaines régions de six provinces : Colombie-Britannique, Manitoba, Ontario, Québec, Nouveau-Brunswick et Nouvelle-Écosse. La Saskatchewan et l’Île-du-Prince-Édouard ont récemment documenté un cas chacune, ces cas provenant vraisemblablement de bactéries établies localement (indigènes). Pour diagnostiquer efficacement la maladie de Lyme, il faut estimer « l’exposition », que sa répartition hétérogène rend plus difficile. Auparavant, l’exposition pouvait être définie par les antécédents de voyage du sujet, mais maintenant, les médecins et les autorités en santé publique doivent évaluer le risque que l’agent causal soit établi au Canada. Comme la limite septentrionale de l’aire de propagation des tiques vectrices de la maladie traverse actuellement le Canada et que des données fiables semblent confirmer sa récente expansion, on devra réévaluer en continu l’étendue de la maladie afin d’assurer une surveillance efficace. Dans un proche avenir, il est probable que la majorité des Canadiens vivront dans des régions où la maladie de Lyme s’est installée.
La présente Note mauve vise les quatre objectifs suivants : 1) faire le point sur l’épidémiologie actuelle de la maladie de Lyme au Canada, 2) résumer l’information sur l’écologie de ses vecteurs et déterminer comment cette information peut éclairer les activités de surveillance, 3) discuter de prévisions concernant sa propagation, 4) décrire brièvement d’autres maladies transmises par les tiques et leur co-occurrence avec la maladie de Lyme. La présente Note mauve est associée à une autre qui souligne le parcours menant au diagnostic de la maladie de Lyme.
2. Épidémiologie au Canada
La maladie de Lyme est une infection causée par le spirochète Borrelia burgdorferi. C’est une bactérie présente en milieu naturel chez des tiques du genre Ixodes (en Amérique du Nord, surtout I. scapularis, mais aussi I. pacificus et peut-être d’autres espèces) et un certain nombre de petits mammifères et oiseaux chanteurs. Chez les humains, l’infection par B. burgdorferi débute par une phase cutanée marquée par une maladie fébrile aiguë aux symptômes semblables à ceux de la grippe—fièvre modérée, arthralgie, myalgie, nausées—généralement accompagnée d’un érythème (quasi) pathognomique en forme de cible.2, 3 Si l’infection n’est pas traitée, la bactérie peut se propager à plusieurs systèmes. Le stade précoce de la maladie se caractérise très souvent par des symptômes neurologiques (paralysie de Bell, névrite crânienne ou radiculaire, méningite) ou cardiaques (blocage atrioventriculaire, myopéricardite, pancardite). À un stade plus avancé, elle entraîne l’arthrite caractéristique de la maladie de Lyme,4 et d’autres symptômes neurologiques,55 avec une progression très variable. Le traitement est simple, soit l’administration d’antibiotiques, et son efficacité est accrue s’il est amorcé à un stade précoce. À mesure que la maladie progresse, on observe une augmentation des probabilités de séquelles étendues, qui sont probablement des effets résiduels de l’inflammation. Jusqu’à présent, aucun élément probant ne démontre le retour de l’infection après le traitement.6, 7, 8
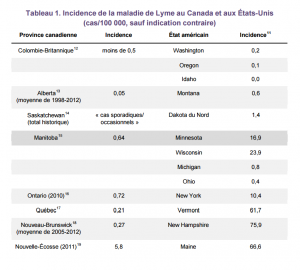
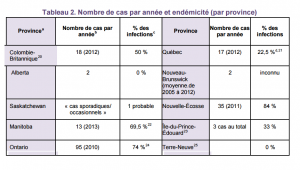
Aux États-Unis, environ 34 000 cas confirmés ont été signalés en 2011, mais l’incidence annuelle réelle serait estimée à 300 000 cas.9 En 2011, il y a eu 258 cas confirmés au Canada.10 Le tableau 1 compare l’incidence de la maladie de Lyme au Canada et aux États-Unis.
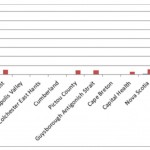
On peut constater la nature focale de la maladie et sa capacité à se propager en regardant l’exemple de son incidence (cas/100 000) recensée par les régies régionales de la santé de la Nouvelle-Écosse sur une période de dix ans.19
South Shore = Côte Sud; South West = Sud-Ouest; Annapolis Valley = Vallée de l’Annapolis; Colchester East Hants = Colchester East Hants; Cumberland = Cumberland; Pictou County = Comté de Pictou; Guysborough Antigonish Strait = Guysborough; Antigonish Strait; Cape Breton = Cap-Breton; Capital Health = Régie régionale de la santé de la Capitale; Nova Scotia = Nouvelle-Écosse
3. Biologie et écologie des vecteurs
L’agent responsable de la maladie de Lyme en Amérique du Nord, B. burgdorferi, est un parasite interne obligatoire qui infecte l’humain suivant un cycle évolutif passant par les tiques du genre Ixodes, de petits mammifères ou des oiseaux.26 Au niveau de la santé publique, l’information sur la biologie et l’écologie des vecteurs peut être mise à profit pour trois usages principaux : prévention, organisation d’une surveillance efficace et planification pour l’avenir.
Ixodes scapularis (tique à pattes noires) est le principal vecteur de B. burgdorferi en Amérique centrale et dans le Nord-Est de l’Amérique du Nord, et Ixodes pacificus (tique occidentale à pattes noires) est la principale tique vectrice de ce spirochète dans la région nord-ouest de la côte du Pacifique. Les hôtes les plus communs d’I. scapularis représentent une grande variété de mammifères, de lézards et d’oiseaux,27 parmi lesquels figurent des vecteurs compétents de B. burgdorferi, dont plusieurs espèces28 de souris, de rats, de musaraignes, de tamias, d’écureuils, et au moins neuf espèces.e de passereaux.29 La souris à pattes blanches (Peromyscus leucopus) est particulièrement importante dans les régions habitées.30,31 Les humains, les cerfs et les autres grands mammifères ne sont pas des vecteurs compétents de la bactérie.27 Le cerf de Virginie joue un double rôle dans la prévalence naturelle de la maladie de Lyme : il est un hôte important des tiques adultes et contribue à la densification des populations de tiques, mais il ne transmet pas la maladie, ce qui contribue à réduire la prévalence de la bactérie chez les tiques par la zooprophylaxie.61
Une troisième espèce de tiques, Ixodes uriae (tique d’oiseaux de mer), est un vecteur potentiel le long de la côte Atlantique. Dix tiques I. uriae sur 61 de l’île Gull, à Terre-Neuve, ont été identifiées comme étant porteuses de B. garinii, un vecteur de la borréliose de Lyme retrouvée en Europe.32 B. garinii pourrait ainsi être introduit dans les populations de mammifères au Canada.33 et entraîner des cas de borréliose de Lyme en Amérique du Nord présentant des symptômes très divergents.
Les tiques du genre Ixodes passent par trois stades de vie active—larve, nymphe et adulte—qui sont similaires, et elles se nourrissent de sang; à ces trois stades, elles peuvent être porteuses de B. burgdorferi et le transmettre. Les oeufs éclosent à la fin du printemps ou en été; les larves cherchent alors de petits mammifères à parasiter et se nourrissent de leur sang une seule fois. Une fois gorgée de sang, elles se transforment en nymphes et entrent en quiescence pour l’hiver. Le printemps suivant, les nymphes cherchent un autre hôte et se nourrissent à nouveau, puis, à l’automne, se transforment en adultes et cherchent de plus grands mammifères à parasiter, surtout des cerfs, pour se gorger de sang une dernière fois. Enfin, elles s’accouplent, pondent leurs oeufs et meurent.34
Dans ce cycle évolutif, la nymphe est la principale menace pour la transmission de la maladie de Lyme aux humains.35,36 Les larves récemment écloses deviennent infectées lorsqu’elles se nourrissent sur un hôte infecté pouvant transmettre la bactérie. Après s’être transformées en nymphes, elles cherchent un second hôte vertébré qui peut être un vecteur compétent (beaucoup de rongeurs, certains oiseaux) ou pas (humains, cerf de Virginie). Si l’hôte est compétent, le cycle de la maladie de Lyme est complété. Les tiques adultes peuvent aussi transmettre la maladie aux humains, mais dans une moindre mesure; comme elles sont plus grandes que les nymphes, elles sont plus facilement repérées et extirpées.37
Les tiques du genre Ixodes se développent dans les conditions suivantes :38
● litière humide (couche de feuilles mortes), surtout dans les forêts de feuillus
● boisés
● basses-terres
● milieux humides et leurs pourtours
● populations denses de cerfs et de petits rongeurs
Il existe un lien entre plusieurs vecteurs de la maladie de Lyme (p. ex. la souris à pattes blanches et le tamia rayé) et des habitats polyvalents, périurbains et fragmentés,39 à proximité des humains, qui hébergent souvent des densités élevées de cerfs et de rongeurs. L’apparition et la propagation rapide de la maladie de Lyme en Nouvelle-Angleterre dans les 40 dernières années, par exemple, sont probablement liées à l’abandon à grande échelle de terres agricoles.40,41 et au développement d’un paysage écologique fractionné qui combine des banlieues et des îlots boisés. La maladie ne devrait pas être considérée comme une infection du milieu rural. Une controverse persiste39 sur l’importance relative des cerfs et des petits rongeurs, notamment les espèces du genre Peromyscus et de musaraignes. Une transmission stable de B. burgdorferi entre les tiques et leurs hôtes peut être observée dans des îlots isolés d’une superficie aussi petite que 50 hectares.42
4. Surveillance des populations de tiques
Deux niveaux de surveillance existent pour la maladie de Lyme. Le premier concerne les populations d’I. scapularis (ou I. pacificus), car la découverte d’une nouvelle population indique que la maladie pourrait devenir endémique. Le second niveau est le contrôle des tiques Ixodes pour la présence de B. burgdorferi, qui est une mesure directe du risque existant.
Dans une approche de surveillance passive, les tiques apportées par des citoyens sont soumises aux autorités sanitaires aux fins d’identification et d’analyse pour la présence de la bactérie. Cette approche peut être très efficace; c’est d’ailleurs la principale méthode utilisée en Alberta et en Saskatchewan, où la maladie n’est pas encore endémique. Mais elle requiert un spécialiste sur place pour distinguer les tiques du genre Ixodes et les faire analyser dans un laboratoire externe pour la présence de B. burgdorferi.
La surveillance active est appropriée dans les régions où la maladie semble devenir endémique. Un chiffon blanc est systématiquement passé dans des sites potentiels – couverture de feuilles mortes, herbe, terrains broussailleux ou pelouses. Les tiques repérées doivent être prélevées et identifiées; celles du genre Ixodes (nymphes et adultes) sont ensuite soumises à un test d’identification de B. burgdorferi. Le comportement des tiques est hautement influencé par le cycle saisonnier local, et la surveillance devrait être synchronisée avec l’activité des nymphes à la recherche d’hôtes.
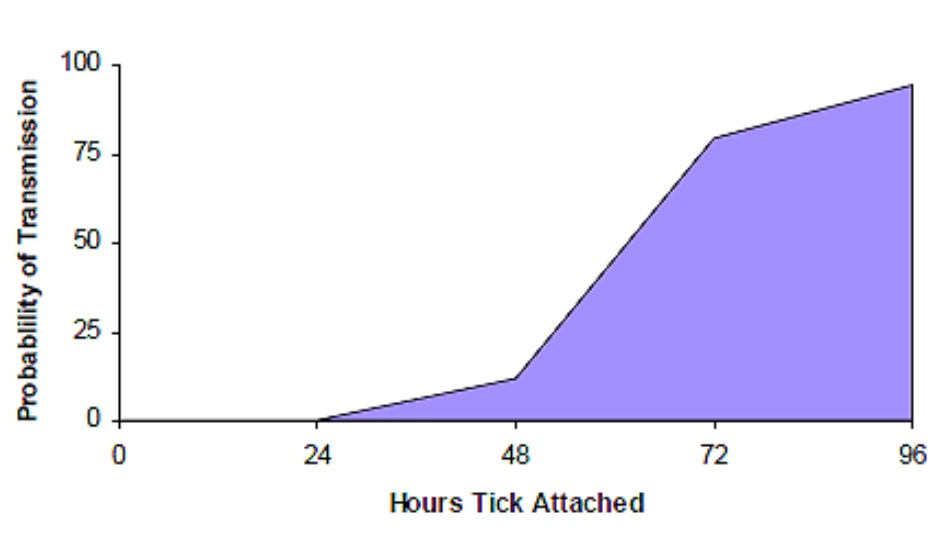
En soumettant une tique pour analyse, il importe de se rappeler qu’il faut au moins 24 heures de contact, et généralement plus, pour la transmission de la bactérie.
Source : Ministère de la Santé et des Soins de longue durée de l’Ontario43
Probability of Transmission = Probabilité de transmission
Hours Tick Attached = Nombre d’heures de fixation de la tique
Plusieurs variables peuvent éclairer la planification de la surveillance de base et les mises en garde locales. Un simple dénombrement de la population de nymphes d’I. scapularis est un excellent indicateur du risque pour les humains.35 En complément, la consignation des données sur le nombre de tiques soumises aux fins d’identification en fonction de la population humaine peut aider à reconnaître l’émergence de populations d’I. scapularis.44 La présence de nombreuses tiques à pattes noires non infectées pourrait être l’indication d’une population émergente; cette forme de surveillance passive peut donner lieu à un ensemble de données alimenté par toute personne intéressée concernant les mouvements respectifs d’I. scapularis et de B. burgdorferi.
Les populations de cerfs de Virginie sont associées aux populations d’I. scapularis. Les mesures sur les populations de petits rongeurs peuvent être particulièrement utiles. Des recherches ont identifié deux mesures comme étant les meilleurs prédicteurs du risque local : la densité des populations de souris à pattes blanches et de tamias de l’année précédente, et la densité de glands des deux années précédentes.45 Les outils de système d’information géographique (SIG) qui prennent en compte la végétation, le type de sol, l’humidité au sol et d’autres variables peuvent aussi être utiles.46
Les travaux de Piesman42 soulignent ce qui est peut-être le facteur le plus important pour la gestion locale de la surveillance, le contrôle et la promotion de la santé, soit l’association étroite entre I. scapularis et la couche de feuilles mortes.
5. Répartition actuelle et changements potentiels au Canada
« L’endémicité » de la maladie de Lyme dans une région est un élément important du diagnostic. Le fait de connaître son endémicité permet aux médecins d’estimer l’exposition d’un patient et de traiter les cas cliniques présumés. L’Agence de santé publique du Canada (ASPC) définit un site endémique comme suit :47
Une région endémique confirmée de la maladie de Lyme désigne un endroit où la surveillance active a permis de détecter, d’une part, des populations reproductrices de tiques vectrices, comme le confirme la présence de tiques aux trois stades de développement (larve, nymphe, adulte) sur des animaux de la région ou dans le milieu pendant au moins deux années consécutives, et, d’autre part, la présence de l’agent de la maladie de Lyme (B. burgdorferi) chez les tiques ou les animaux sauvages hôtes des tiques recueillis dans la région, selon les données obtenues grâce aux méthodes de culture, moléculaires (plus précisément la PCR) ou d’immunofluorescence des anticorps (IFA).
Une région endémique présumée de la maladie de Lyme désigne un endroit où la surveillance active sur le terrain a révélé la présence de nombreuses tiques au cours d’une ou de plusieurs visites, ce qui porte à croire que la tique vectrice est établie. Pour qu’il s’agisse d’une région endémique présumée, la B. burgdorferi doit avoir été détectée chez les tiques ou les animaux recueillis sur place.
La définition concrète d’une région endémique est laissée à la compétence des autorités provinciales. Deux approches peuvent être utilisées :
- En fonction du site : cette approche définit les sites qui satisfont aux critères d’endémicité de l’ASPC.
- En fonction de la région : cette approche suppose que la surveillance est partielle, qu’il n’y a pas d’observation de l’expansion ou de la diminution des populations de tiques et que la présence d’une seule population vectrice de B. burgdorferi indique l’émergence probable d’autres populations.
L’exemple de la Nouvelle-Écosse illustre bien la différence entre les deux approches. Un rapport émis récemment par le gouvernement provincial indique ce qui suit :19 [traduction libre]
Les premières populations endémiques de tiques en Nouvelle-Écosse ont été identifiées dans le comté de Lunenburg en 2003, dans les localités de Garden Lots, Blue Rocks, First Peninsula et Heckman’s Island. La seconde région endémique, le parc Admiral’s Cove à Bedford, dans le comté de Halifax, a été identifiée en 2006. En 2008, l’anse Gunning, comté de Shelburne, a été déclarée région endémique. En août 2010, des secteurs entourant la plage Melmerby, Egerton, Kings Head et Pine Tree, dans le comté de Pictou, ont aussi été déclarés endémiques. La cinquième région endémique de la Nouvelle-Écosse est Gavelton, comté de Yarmouth, identifiée en décembre 2011.
Une définition en fonction du site restreindrait l’exposition autour du parc Admiral’s Cove de Halifax.
Si une définition moins contraignante du mot « endémique »était adoptée, l’exposition humaine pourrait alors être estimée en fonction des comportements dans une région plus vaste et non par la fréquentation de régions délimitées précisément. C’est cette approche qui a été adoptée par la Nouvelle-Écosse; la carte des secteurs à risque couvre toute la région de la capitale, indiquant que de nombreuses activités pratiquées dans ce secteur peuvent être l’indication clinique d’une exposition. La valeur de cette approche tient à la vigilance accrue des médecins quant au diagnostic de la maladie de Lyme, mais cela entraîne probablement une augmentation des analyses chez des personnes qui ne sont pas infectées. L’utilité de cette approche dépend des conditions locales. Par exemple, elle a été adoptée dans la région de la Montérégie, au sud de Montréal, où l’on a identifié l’émergence d’une grande quantité de populations d’I. scapularis et où la répartition des tiques et de l’infection forme une mosaïque changeante; le rapport de l’ASPC indiquant « 5 régions endémiques connues » ne donne pas plus de détails,47 et il n’y a aucune carte illustrant cette répartition.
Enfin, il peut être risqué de croire que la maladie de Lyme se limite uniquement aux sites endémiques définis. Des tiques du genre Ixodes pénètrent toujours plus loin au Canada grâce à leurs hôtes; I. scapularis a été identifiée dans toutes les provinces, même dans un cas près de Slave Lake, en Alberta, situé à une distance de 1760 kilomètres de la population connue la plus proche.48 On estime qu’entre 45 et 175 millions d’I. scapularis entrent au Canada de cette façon chaque année, et environ 12 à 15 pour cent de celles qui sont disséminées accidentellement seraient porteuses de B. burgdorferi.49,50 Au moins deux humains ont été contaminés par suite de cette propagation, l’un en Saskatchewan, l’autre à l’Île-du-Prince-Édouard.
6. Propagation future
Des recherches indiquent qu’au cours des dernières années, la latitude est le prédicteur le plus important quant à la variation de l’incidence de la maladie de Lyme aux États-Unis,51 les États du Sud ayant observé une diminution de l’incidence tandis que les États du Nord enregistraient une augmentation. Cela est tout à fait compatible avec la récente propagation d’I. scapularis au Canada, l’établissement de populations reproductrices et la transmission locale de B. burgdorferi. La présence de cette tique est la mesure la plus simple du risque lié à la maladie de Lyme; elle est aujourd’hui retrouvée dans le sud du Manitoba, suivant une longue ligne discontinue entre le sud de l’Ontario et la Montérégie ainsi que dans deux sites au Nouveau-Brunswick, et couvrant une vaste superficie de la Nouvelle-Écosse. La maladie étend son territoire proche de tous les grands centres urbains entre Windsor et Halifax. Selon une étude, le territoire d’I. scapularis dans l’Est du Canada pourrait s’agrandir de 46 km/an,52 indépendamment de l’introduction de B. burgdorferi, mais on prévoit que d’ici 2020, 80 pour cent de la population humaine de l’Est du Canada (y compris le Manitoba) vivront dans des régions ayant des populations établies de tiques du genre Ixodes.
Les tiques peuvent être introduites en populations animales par des oiseaux ou des mammifères terrestres.53 L’établissement de la maladie de Lyme se fait en deux phases. D’abord, les tiques I. scapularis établissent une population reproductrice, qui peut toucher un site très précis. Pour une population endémique d’hôtes de tiques, la probabilité d’introduction de B. burgdorferi est assez élevée; la « pluie » constante de tiques provenant des oiseaux fournit une source fondatrice de bactéries, et les mammifères pouvant servir de vecteurs sont communs au Canada. Dans l’Est du pays, le décalage entre l’établissement d’une population d’I. scapularis et l’introduction de B. burgdorferi serait d’environ 5 ans, et d’environ 3 ans dans le Centre du Canada.54
En Colombie-Britannique, la possibilité d’une augmentation est plus faible puisque les régions endémiques couvrent déjà de grands centres urbains comme Vancouver, les basses-terres continentales, Victoria et le sud de l’île de Vancouver.12 Rien ne laisse présager que la prévalence de la maladie de Lyme pourrait augmenter sur la côte ouest.
Au-delà de l’horizon à court terme, Brownstein et ses collaborateurs55 ont estimé que vers les années 2080, le nord de l’Ontario et du Manitoba présenteront des habitats favorables pour I. scapularis.
7. Autres maladies transmises par les tiques
Cinq maladies distinctes sont transmises par I. scapularis dans le Nord-Est des États-Unis : la maladie de Lyme (Borrelia burgdorferi), la babésiose (Babesia microti), l’anaplasmose granulocytaire humaine (Anaplasma phagocytophilum), l’encéphalite à tiques et la méningoencéphalite (Borrelia miyamotoi).56 Cette section traitera de la coexistence de ces maladies avec les maladies transmises par d’autres tiques non vectrices de la maladie de Lyme.
Babésiose
Transmise par I. scapularis, cette maladie est causée par le parasite protozoaire Babesia microti (rarement d’autres espèces de Babesia). Sa répartition en Amérique du Nord est largement corrélée avec celle de la maladie de Lyme; de fait, une étude indique que de 2,9 à 6,2 pour cent des tiques à pattes noires sont porteuses des deux maladies.57,58 La babésiose entraîne des symptômes semblables à ceux de la grippe, mais pas d’érythème chronique migrant. Contrairement à la maladie de Lyme, elle peut être transmise verticalement chez les humains et les tiques vectrices, ainsi que par la transfusion sanguine. Cette infection potentiellement fatale est plus sévère que la maladie de Lyme.
Anaplasmose granulocytaire humaine (AGH)
L’AGH est transmise par I. scapularis et par I. pacificus en Amérique du Nord, mais sa répartition suit celle de la maladie de Lyme avec une incidence beaucoup plus faible.59 Elle cause des symptômes semblables à ceux de la grippe, généralement plus sévères qu’au stade précoce de la maladie de Lyme, et souvent une thrombocytopénie, une leucopénie ou une augmentation des enzymes hépatiques; l’AGH n’a pas de symptômes distinctifs et le diagnostic nécessite une confirmation en laboratoire.60 Cette zoonose a été introduite dans le sud-ouest du Québec61 par un cycle de pathogénicité inconnu.
Entre 2,3 et 10 pour cent des patients qui présentent un érythème chronique migrant sont aussi atteints d’AGH.62 Le traitement est le même que pour la maladie de Lyme.
Autres espèces de Borrelia en Amérique du Nord
La fièvre récurrente (FR) transmise par les tiques est causée par plusieurs espèces du genre Borrelia qui ne transmettent pas la maladie de Lyme : B. hermsii, B. parkerii et B. turicatae. Cette fièvre est fréquente dans le Sud-Ouest du Canada et l’Ouest des États-Unis et semble être associée à l’occupation de cabanes infestées par des rongeurs. Les symptômes sont généralement similaires à ceux de la maladie de Lyme, sans l’érythème en forme de cible, et peut être accompagnée de périodes fébriles d’environ 3 jours à des intervalles de 7 jours. La fièvre récurrente est transportée par plusieurs espèces de tiques molles du genre Ornithodoros.59
La présence de B. miyamotoi, dont la capacité d’infecter les humains n’a été reconnue que récemment, est maintenant documentée dans toutes les régions des États-Unis où il y a la maladie de Lyme, y compris la côte ouest63. Elle peut être confondue avec l’AGH59 ou la maladie de Lyme. Sa prévalence chez les tiques est huit fois moins élevée que celle de la maladie de Lyme.64
Virus de l’encéphalite Powassan
Le virus de Powassan est le seul membre du complexe viral de la tique du cerf en Amérique du Nord, où deux lignées existent, l’une transportée par I. scapularis (lignée DTV), l’autre par I. cookei et I. marxi (lignée POW). Des données probantes indiquent une expansion depuis 1977.65 Les symptômes initiaux ne sont pas spécifiques, mais il s’agit d’une infection plus sévère que la maladie de Lyme, avec une progression normale vers des symptômes neurologiques graves.59
Borréliose de Lyme en Europe
Chaque année, 85 000 cas de borréliose de Lyme sont répertoriés en Europe. Parmi les pays où prévaut une incidence importante, mentionnons l’Autriche, la Slovaquie, l’Allemagne, la Bulgarie, la France et la République tchèque, ainsi que les régions bordant la mer Baltique; cependant, des cas ont été recensés dans presque tous les pays européens. Comme en Amérique du Nord, cette maladie est propagée par les tiques du genre Ixodes, qui préfèrent les forêts feuillues avec un taux d’humidité élevé.66
La borréliose de l’Europe transmise par les tiques regroupe un ensemble de maladies causées par plusieurs espèces de Borrelia, surtout B. afzelli et B. garinii, mais aussi B. burgdorferi et possiblement B. bavariensis.67 Les symptômes sont variables. Lorsqu’on suspecte un cas de borréliose européenne, il est recommandé d’effectuer un test C6 Elisa comme test autonome68 ou comme test de confirmation après un premier test WCS Elisa.69
Ehrlichiose
Cette infection ressemble à l’AGH mais est transmise par la tique étoilée américaine, trouvée surtout dans le Sud et le Sud-Ouest des États-Unis.59 Elle est causée par Ehrlichia ewingii et E. chaffeensis. À en juger par la répartition de la tique étoilée américaine (voir plus bas), cette maladie pourrait se propager vers le nord; cela ne signifie pas que sa propagation soit limitée par des variables liées au climat, aux interactions de type vectoriel ou à d’autres facteurs.
Maladie à éruptions cutanées associée aux tiques du Sud – STARI
Cette maladie à éruptions cutanées est causée par un organisme inconnu (peut-être Borrelia lonestari) associé à la morsure par Amblyomma americanum, la tique étoilée américaine.70 Elle entraîne un érythème en forme de cible classique, mais rarement d’autres symptômes comme la fièvre, les maux de tête, la fatigue et les douleurs musculaires.71 Aucun traitement n’a démontré son efficacité et il n’y a aucune preuve de séquelle à long terme. Cette maladie a comme impact clinique principal de donner lieu à de faux diagnostics de la maladie de Lyme. Selon une analyse des différentes stratégies de traitement, chez des patients qui présentent une éruption cutanée en forme de cible et qui peuvent avoir été exposés à la maladie de Lyme (c.-à-d. avec un comportement propice et dans une région appropriée), un traitement contre la maladie de Lyme présumée est préférable d’un point de vue clinique et économique.72
Wormser et ses collaborateurs.73 ont identifié les différences cliniques suivantes entre la maladie de Lyme et la maladie à éruptions cutanées (STARI) :
- Les patients souffrant de STARI ont moins souvent des symptômes autres que les éruptions cutanées caractéristiques (19 pour cent au lieu de 76 pour cent)
- Les éruptions cutanées associées à la STARI ont plus souvent une forme circulaire avec une partie centrale claire (76 pour cent contre 22 pour cent)
- Les patients souffrant de la STARI sont moins sujets aux lésions multiples, et les lésions sont plus petites (6 à 10 cm contre 6 à 28 cm)
La maladie à éruptions cutanées associée aux tiques du Sud (STARI) devrait être envisagée avec une probabilité plus élevée si un patient se présente avec un érythème chronique migrant et des antécédents d’exposition dans le sud ou l’ouest du Maryland. La Virginie et le Maryland sont les deux États où le chevauchement entre les secteurs touchés par la STARI et par la maladie de Lyme est le plus ìmportant.
Notes
a Sauf indication contraire, les sources sont les mêmes que pour le tableau précédent.
b Cas confirmés dans les plus récentes données disponibles.
c Ce chiffre ne correspond pas à la même année que pour le nombre de cas par année et représente souvent le résultat combiné de plusieurs années ou une estimation pour une province qui ne précise pas les limites des données.
d Représente la moyenne historique; récemment, la proportion des infections indigènes a dépassé les 50 %.
e Troglodyte de Bewick, paruline masquée, junco ardoisé, junco de l’Oregon, carouge à épaulettes, bruant chanteur, grive à dos olive, bruant des marais, bruant à gorge blanche (Scott et coll., 2012).
Bibliographie
1 Ogden, N.H., Lindsay, L.R., Morshed, M., Sockett, P.N., Artsob, H. The emergence of Lyme disease in Canada. Canadian Medical Association Journal. 2009;180(12):1221-4.
2 Wormser, G.P. Early Lyme disease. New England Journal of Medicine. 2006;354(26):2794-801.
3 Edlow, J.A. Diagnosing Lyme Disease: Getting the details right. Comment on “Infecting the Electrocardiogram” Diagnosing Lyme Disease. Archives of Internal Medicine. 2012;172(21):1625-6.
4 Kaluarachchi, D., Mendez, M., Khanna, S. Lyme arthritis vs acute bacterial arthritis: A diagnostic dilemma. International Journal of Case Reports and Images. 2013:3(12)62-64.
5 Nichols, C., Windemuth, B. Lyme disease: From early localized disease to post-Lyme disease syndrome. The Journal for Nurse Practitioners. 2013;9(6):362-7.
6 Wormser, G.P., Dattwyler, R.J., Shapiro, E.D., Halperin, J.J., Steere, A.C., Klempner, M.S., et coll. The clinical assessment, treatment, and prevention of Lyme disease, human granulocytic anaplasmosis, and babesiosis: clinical practice guidelines by the Infectious Diseases Society of America. Clinical Infectious Diseases. 2006;43(9):1089-134.
7 Lantos, P.M., Auwaerter, P.G., Wormser, G.P. A systematic review of Borrelia burgdorferi morphologic variants does not support a role in chronic Lyme disease. Clinical Infectious Diseases. 2013:cit810.
8 Feder Jr., H.M., Johnson, B.J., O’Connell, S., Shapiro, E.D., Steere, A.C., Wormser, G.P. A critical appraisal of “chronic Lyme disease”. New England Journal of Medicine. 2007;357(14):1422-30.
9 Kuehn, B.M. CDC Estimates 300 000 US Cases of Lyme Disease Annually Medical News & Perspectives. JAMA. 2013;310(11):1110-.
10 Avis de santé publique : Maladie de Lyme [Internet]. Ottawa : Agence de la santé publique du Canada : Maladie de Lyme [2014] – [cité le 27 janvier 2014]. Disponible au : http://www.phac-aspc.gc.ca/phn- asp/2013/lyme-0730-fra.php
11 Lyme Disease Incidence Rates by State, 2003-2012 [Internet]. Atlanta : Centers for Disease Control and Prevention : Lyme Disease [2013] – [cité le 27 janv 2014]. Disponible au : http://www.cdc.gov/lyme/stats/chartstables/incidenceby state.html
12 Henry, B., Morshed, M. Lyme disease in British Columbia: Are we really missing an epidemic? British Columbia Medical Journal. 2011;53(5).
13 Health Information Lyme Disease [Internet]. Edmonton: Gouvernement de l’Alberta: Alberta Health: Health Information [2013] – [cité le 27 janv 2014]. Disponible au : http://www.health.alberta.ca/health- info/lyme-disease.html
14 Public Health Lyme Disease [Internet]. Saskatoon: Saskatchewan Ministry of Health: Public Health: Prevention and Protection: Disease Prevention: Lyme Disease [2012] – [cité le 27 janvier 2014]. Disponible au : http://www.health.gov.sk.ca/lyme-disease
15 Cas déclarés de maladie de Lyme au Manitoba [Internet]. Winnipeg : gouvernement du Manitoba : Santé Manitoba : Santé publique : Salubrité de l’environnement : Maladie de Lyme [2013] – [cité le 27 janvier 2014]. Disponible au : http://www.gov.mb.ca/health/lyme/stats.fr.html
16 Sider, D., Patel, S., Russell, C., Jain-Sheehan, N., Moore, S. Technical Report: Update on Lyme Disease Prevention and Control. Toronto (Ont.): Public Health Ontario; fév. 2012, 22 p.
17 Portail santé mieux-être, Maladie de Lyme [Internet]. Ville de Québec : gouvernement du Québec : Portail santé mieux-être [2013] – [cité le 27 janvier 2014]. Disponible au : http://sante.gouv.qc.ca/problemes-de- sante/maladie-de-lyme/
18 Bureau du médecin-hygiéniste en chef (Santé publique) [Internet]. Fredericton : Bureau du médecin- hygiéniste en chef (Santé publique) : Maladie de Lyme : Fiche d’information [2012] – [cité le 27 janv 2014]. Disponible au : http://www2.gnb.ca/content/dam/gnb/Departments/h-s/pdf/fr/MaladiesTransmissibles/FichesDinformation/maladiedelyme.pdf
19 Population Health Assessment and Surveillance. Lyme Disease A Report on Lyme Disease Epidemiology and Surveillance in Nova Scotia. Halifax : Nova Scotia Department of Health and Wellness; 25 avril 2012.
20 Communicable Disease Prevention and Control Services, BC Centre for Disease Control. British Columbia Annual Survey of Reportable Diseases. Vancouver : Provincial Health Services Authority; sept. 2013, 128 p.
21 Direction de la santé publique de Montréal, gouvernement du Québec [Internet]. Montréal : Maladie de Lyme [2014] – [cité le 27 janvier 2014]. Disponible au : http://www.dsp.santemontreal.qc.ca/ dossiers_thematiques/infections_et_intoxications/thematiques/maladie_de_lyme/problematique.html
22 Gouvernement du Manitoba. Lyme Disease Update: Established Blacklegged Tick populations identified in Manitoba [Internet]. Winnipeg: Government of Manitoba [2012] – [cité le 27 janvier 2014]. Disponible au : http://news.gov.mb.ca/news/?item=13372
23 Chief Public Health Office, Lyme Disease [Internet]. Charlottetown: Government of Prince Edward Island: Department of Health and Wellness [2013] – [cité le 27 janvier 2014]. Disponible au : http://www.gov.pe.ca/health/LymeDisease
24 Agence ontarienne de protection et de promotion de la santé (Santé publique Ontario). Sommaire sur les maladies à transmission vectorielle 2012 (en anglais). Toronto, Ont.: Imprimeur de la Reine pour l’Ontario; 2013.
25 Animal Health Division, Department of Natural Resources. Lyme Disease in Newfoundland. St. John’s: Government of Newfoundland; juillet 2011, 2 p.
26 Stanek, G., Wormser, G.P., Gray, J., Strle, F. Lyme Borreliosis. The Lancet. 2012;379(9814):461-73.
27 Tsao, J.I. Reviewing molecular adaptations of Lyme borreliosis spirochetes in the context of reproductive fitness in natural transmission cycles. Veterinary Research. 2009;40(2):1.
28 Goldstein, I., Black, M., Leydet Jr., B., Vidrine, S. Hitting the target: Lyme or STARI? The Journal of the Louisiana State Medical Society: Official organ of the Louisiana State Medical Society. 2012;165(2):83-7.
29 Scott, J.D., Anderson, J.F., Durden, L.A. Widespread dispersal of Borrelia burgdorferi-infected ticks collected from songbirds across Canada. Journal of Parasitology. 2012;98(1):49-59.
30 Rogic, A., Tessier, N., Legendre, P., Lapointe, F.J., Millien, V. Genetic structure of the white-footed mouse in the context of the emergence of Lyme disease in southern Québec. Ecology and Evolution. 2013:3(7):2075-2088.
31 Bouchard, C., Beauchamp, G., Nguon, S., Trudel, L., Milord, F., Lindsay, L., et coll. Associations between Ixodes scapularis ticks and small mammal hosts in a newly endemic zone in southeastern Canada: Implications for Borrelia burgdorferi transmission. Ticks and Tick-borne Diseases. 2011;2(4):183-90.
32 Smith Jr., R.P., Muzaffar, S.B., Lavers, J., Lacombe, E.H., Cahill, B.K., Lubelczyk, C.B., et coll. Borrelia garinii in seabird ticks (Ixodes uriae), Atlantic coast, North America. Emerging Infectious Diseases. 2006;12(12):1909.
33 Gómez-Díaz, E., Boulinier, T., Sertour, N., Cornet, M., Ferquel, E., McCoy, K.D. Genetic structure of marine Borrelia garinii and population admixture with the terrestrial cycle of Lyme borreliosis. Environmental Microbiology. 2011;13(9):2453-67.
34 Eisen, R.J., Piesman, J., Zielinski-Gutierrez, E., Eisen, L. What Do we need to know about disease ecology to prevent Lyme disease in the Northeastern United States? Journal of Medical Entomology. 2012;49(1):11-22.
35 Diuk-Wasser, M.A., Gatewood Hoen, A., Cislo, P., Brinkerhoff, R., Hamer, S.A., Rowland, M., et coll. Human risk of infection with Borrelia burgdorferi, the Lyme disease agent, in eastern United States. American Journal of Tropical Medicine and Hygiene. 2012;86(2):320.
36 Connally, N.P., Ginsberg, H.S., Mather, T.N. Assessing peridomestic entomological factors as predictors for Lyme disease. Journal of Vector Ecology. 2006;31(2):364-70.
37 Wisconsin Ticks and Tick-Borne Diseases [Internet]. Madison: University of Wisconsin, Madison [2012] – [cité le 27 janvier 2014]. Disponible au : http://labs.russell.wisc.edu/wisconsin-ticks/ixodes-scapularis-life-cycle/
38 Piesman, J., Gern, L. Lyme borreliosis in Europe and North America. Parasitology-Cambridge. 2004;129:S191.
39 Levy. S. The Lyme disease debate host biodiversity and human disease risk. Environmental Health Perspectives. 2013;121(4):a120.
40 Léger, E., Vourc’h, G., Vial, L., Chevillon, C., McCoy, K.D. Changing distributions of ticks: Causes and consequences. Experimental and Applied Acarology. 2013;59(1-2):219-44.
41 Ogden, N.H., Mechai, S., Margos, G. Changing geographic ranges of ticks and tick-borne pathogens: Drivers, mechanisms and consequences for pathogen diversity. Frontiers in Cellular and Infection Microbiology. 2013;3.
42 Piesman, J. Ecology of Borrelia burgdorferi sensu lato in North America. Lyme Borreliosis: Biology of the Infectious Agents and Epidemiology of Disease CABI Publishing. 2001:223-49.
43 Maladie de Lyme [Internet]. Toronto : Ontario, ministère de la Santé et des Soins de longue durée [2013] – [cité le 27 janvier 2014]. Disponible au : http://www.health.gov.on.ca/fr/public/publications/disease/lyme.aspx
44 Koffi, J.K., Leighton, P.A., Pelcat, Y., Trudel, L., Lindsay, L.R., Milord, F., et coll. Passive surveillance for I. scapularis ticks: enhanced analysis for early detection of emerging Lyme disease risk. Journal of Medical Entomology. 2012;49(2):400-9.
45 Ostfeld, R.S., Canham, C.D., Oggenfuss, K., Winchcombe, R.J., Keesing, F. Climate, deer, rodents, and acorns as determinants of variation in Lyme-disease risk. PLoS Biology. 2006;4(6):e145.
46 Guerra, M., Walker, E., Jones, C., Paskewitz, S., Cortinas, M.R., Stancil, A., et coll. Predicting the risk of Lyme disease: Habitat suitability for Ixodes scapularis in the North Central United States. 2002.
47 Maladie de Lyme et autres maladies transmises par les tiques : renseignements à l’intention des professionnels de la santé [Internet]. Ottawa : Agence de la santé publique du Canada [2013] – [cité le 27 janvier 2014]. Disponible au http://www.phac-aspc.gc.ca/id-mi/tickinfo- fra.php
48 Scott, J.D., Fernando, K., Banerjee, S.N., Durden, L.A., Byrne, S.K., Banerjee, M., et coll. Birds disperse ixodid (Acari: Ixodidae) and Borrelia burgdorferi-infected ticks in Canada. Journal of Medical Entomology. 2001;38(4):493-500.
49 Scott, J.D., Lee, M.K., Fernando, K., Durden, L.A., Jorgensen, D.R., Mak, S., et coll. Detection of Lyme disease spirochete, Borrelia burgdorferi sensu lato, including three novel genotypes in ticks (Acari: Ixodidae) collected from songbirds (Passeriformes) across Canada. Journal of Vector Ecology. 2010;35(1):124-39.
50 Ogden, N., Lindsay, L., Hanincová, K., Barker, I., Bigras- Poulin, M., Charron, D., et coll. Role of migratory birds in introduction and range expansion of Ixodes scapularis ticks and of Borrelia burgdorferi and Anaplasma phagocytophilum in Canada. Applied and Environmental Microbiology. 2008;74(6):1780-90.
51 Tuite, A.R., Greer, A.L., Fisman, D.N. Effect of latitude on the rate of change in incidence of Lyme disease in the United States. Canadian Medical Association Open Access Journal. 2013;1(1):E43-E7.
52 Leighton, P.A., Koffi, J.K., Pelcat, Y., Lindsay, L.R., Ogden, N.H. Predicting the speed of tick invasion: an empirical model of range expansion for the Lyme disease vector Ixodes scapularis in Canada. Journal of Applied Ecology. 2012;49(2):457-64.
53 Leighton, P.A., Koffi, J.K., Pelcat, Y., Lindsay, L.R., Ogden, N.H. Predicting the speed of tick invasion: an empirical model of range expansion for the Lyme disease vector Ixodes scapularis in Canada. Journal of Applied Ecology. 2012;49(2):457-64.
54 Ogden, N.H., Lindsay, L.R., Leighton, P.A. Predicting the rate of invasion of the agent of Lyme disease Borrelia burgdorferi. Journal of Applied Ecology. 2013.
55 Brownstein, J.S., Holford, T.R., Fish, D. Effect of climate change on Lyme disease risk in North America. EcoHealth. 2005;2(1):38-46.
56 Chowdri, H.R., Gugliotta, J.L., Berardi, V.P., Goethert, H.K., Molloy, P.J., Sterling, S.L., et coll. Borrelia miyamotoi infection presenting as Human Granulocytic Anaplasmosis: A Case Report. Annals of Internal Medicine. 2013;159(1):21-7.
57 Chan, K., Marras, S.A., Parveen, N. Sensitive multiplex PCR assay to differentiate Lyme spirochetes and emerging pathogens Anaplasma phagocytophilum and Babesia microti. BMC Microbiology. 2013;13(1):295.
58 Schulze, T.L., Jordan, R.A., Healy, S.P., Roegner, V.E. Detection of Babesia microti and Borrelia burgdorferi in Host-Seeking Ixodes scapularis (Acari: Ixodidae) in Monmouth County, New Jersey. Journal of Medical Entomology. 2013;50(2):379-83.
59 Centers for Disease Control and Prevention. Tickborne Diseases of the United States. Atlanta: U.S. Department of Health and Human Services; 2013 21 pages
60 Wormser, G.P., Aguero-Rosenfeld, M.E., Cox, M.E., Nowakowski, J., Nadelman, R.B., Holmgren, D., et coll. Differences and similarities between culture-confirmed Human Granulocytic Anaplasmosis and early Lyme disease. Journal of Clinical Microbiology. 2013;51(3): 954-8.
61 Bouchard, C.P.A., Leighton, G., Beauchamp, S., Nguon, L., Trudel, F., Milord, L.R., Lindsay, C., Bélanger, and Ogden, N.H. Harvested white-tailed deer as sentinel hosts for early establishing Ixodes scapularis populations and risk from vector-borne zoonoses in southeastern Canada. Journal of Medical Entomology 2013; 50 (2): 384-393.
62 Horowitz, H.W., Aguero-Rosenfeld, M.E., Holmgren, D., McKenna, D., Schwartz, I., Cox, M.E., et coll. Lyme Disease and Human Granulocytic Anaplasmosis Coinfection: Impact of case definition on coinfection rates and illness severity. Clinical Infectious Diseases. 2013;56(1):93-9.
63 Krause, P.J., Narasimhan, S., Wormser, G.P., Rollend, L., Fikrig, E., Lepore, T., et coll. Human Borrelia miyamotoi infection in the United States. New England Journal of Medicine. 2013;368(3):291-3.
64 Barbour, A.G., Bunikis, J., Travinsky, B., Hoen, A.G., Diuk-Wasser, M.A., Fish, D., et coll. Niche partitioning of Borrelia burgdorferi and Borrelia miyamotoi in the same tick vector and mammalian reservoir species. The American Journal of Tropical Medicine and Hygiene. 2009;81(6):1120.
65 Anderson, J.F., Armstrong, P.M. Prevalence and genetic characterization of Powassan virus strains infecting Ixodes scapularis in Connecticut. The American Journal of Tropical Medicine and Hygiene. 2012;87(4):754-9.
66 Lindgren, E., Jaenson, T.G. Lyme borreliosis in Europe: influences of climate and climate change, epidemiology, ecology and adaptation measures. WHO Regional Office for Europe Copenhagen; 2006.
67 Stanek, G., Fingerle, V., Hunfeld, K.P., Jaulhac, B., Kaiser, R., Krause, A., et coll. Lyme borreliosis: clinical case definitions for diagnosis and management in Europe. Clinical Microbiology and Infection. 2011;17(1):69-79.
68 Wormser, G.P., Tang, A.T., Schimmoeller, N.R., Bittker, S., Cooper, D., Visintainer, P., et coll. Utility of serodiagnostics designed for use in the United States for detection of Lyme borreliosis acquired in Europe and vice versa. Medical microbiology and immunology. 2013:1-7.
69 Branda, J.A., Strle, F., Strle, K., Sikand, N., Ferraro, M.J., Steere, A.C. Performance of United States serologic assays in the diagnosis of Lyme Borreliosis Acquired in Europe. Clinical Infectious Diseases. 2013.
70 Goldstein, I., Black, M., Leydet Jr., B., Vidrine, S. Hitting the target: Lyme or STARI? The Journal of the Louisiana State Medical Society. 2012;165(2):83-7.
71 Southern Tick Associate Rash Illness: Symptoms, Diagnosis and Treatment [Internet]. Atlanta: Centers for Disease Control and Prevention [2012] – [cité le 27 janvier 2014]. Disponible au : http://www.cdc.gov/stari/symptoms/
72 Lantos, P.M., Brinkerhoff, R.J., Wormser, G.P., Clemen, R. Empiric antibiotic treatment of erythema migrans-like skin lesions as a function of geography: A clinical and cost effectiveness modeling study. Vector-Borne and Zoonotic Diseases. 2013;13(12):877-83.
73 Wormser, G.P., Masters, E., Nowakowski, J., McKenna, D., Holmgren, D., Ma, K., et coll. Prospective clinical evaluation of patients from Missouri and New York with erythema migrans-like skin lesions. Clinical Infectious Diseases. 2005;41(7):958-65.
Prévention et traitement contre les tiques
La prévention de la maladie de Lyme consiste essentiellement à éviter les piqûres de tiques ou à extraire les tiques dans les 24 heures. Des interventions plus poussées sont possibles, mais elles n’ont pas fait l’objet d’évaluations. Les mesures qui suivent sont considérées comme étant efficaces :
• Porter des vêtements protecteurs (manches longues, pantalons, bottes) et rentrer la chemise dans le pantalon et le pantalon dans les chaussettes
• Examiner les vêtements et la peau exposée à la recherche de tiques aux 2 à 3 heures, et pendant une semaine par la suite
• Porter des vêtements imprégnés de perméthrine, et utiliser un insectifuge contenant du PMD ou du DEET (possiblement la pratique la plus réaliste pour les travailleurs à l’extérieur)
• En cas de piqûre, retirer correctement les tiques
• En cas de piqûre, être l’affût de rougeurs, d’une paralysie faciale, de maux de tête ou de symptômes semblables à ceux de la grippe, et de douleurs articulaires
• En cas de piqûre dans une région endémique de la maladie de Lyme, conserver la tique et consulter un médecin généraliste ou un bureau local de santé publique pour savoir si des antibiotiques prophylactiques sont indiqués
Il existe de bonnes raisons de croire que la plupart des gens hésitent à adopter ces mesures. Elles sont techniquement efficaces (p. ex. insectifuge, vêtements traités, pulvérisation massive), mais leur utilisation en promotion de la santé ne repose pas sur des faits éprouvés. Les mesures de santé publique doivent tenir compte du fait que les risques ne sont pas distribués de manière uniforme et que souvent, les gens ne suivent pas les recommandations pour éviter les tiques; par contre, il semble être accepté d’enseigner aux gens comment vérifier s’ils ont des tiques.
L’adaptation du message aux personnes les plus susceptibles d’être exposées aux tiques s’est révélée utile. Par exemple, les personnes qui passent beaucoup de temps à l’extérieur sont à risque, mais n’ont pas besoin de renseignements généraux sur la façon de retirer les tiques; elles devraient plutôt être informées des symptômes de la maladie de Lyme et des mesures à prendre pour éviter les habitats de tiques.
Références
BEAUJEAN, D.,L. VAN VELSEN, J.E. VAN GEMERT-PIJNEN, A. MAAT, J.E. VAN STEENBERGEN et R. CRUTZEN. « Using Risk Group Profiles as a Lightweight Qualitative Approach for Intervention Development: An Example of Prevention of Tick Bites and Lyme Disease », JMIR research protocols, vol. 2, no 2 (2013).
DALTROY, L.H., C. PHILLIPS, R. LEW, E. WRIGHT, N.A. SHADICK et M.H. LIANG. « A controlled trial of a novel primary prevention program for Lyme disease and other tick-borne illnesses », Health education & behavior, vol. 34, no 3 (2007), p. 531-542.
DUE C., W. FOX, J.M. MEDLOCK, M. PIETZSCH et J.G. LOGAN. « Tick bite prevention and tick removal », BMJ: British Medical Journal (2013), p. 347.
EISEN R.J., J. PIESMAN, E. ZIELINSKI-GUTIERREZ et L. EISEN. « What Do We Need to Know About Disease Ecology to Prevent Lyme Disease in the Northeastern United States? », Journal of medical entomology, vol. 49, no 1 (2012), p. 11-22.
GOULD L.H., R.S. NELSONS, K.S. GRIFFITH, E.B. HAYES, J. PIESMAN, P.S. MEAD, et coll. « Knowledge, attitudes, and behaviors regarding Lyme disease prevention among Connecticut residents, 1999-2004 », Vector-Borne and Zoonotic Diseases, vol. 8, no 6 (2008), p. 769-776.
HELLER J.E., E. BENITO-GARCIA, N.E. MAHER, L.B. CHIBNIK, C.P. MAHER et N.A. SHADICK. « Behavioral and attitudes survey about Lyme disease among a Brazilian population in the endemic area of Martha’s Vineyard, Massachusetts ». Journal of Immigrant and Minority Health, vol. 12, no 3 (2010), p. 377-383.
MALOUIN R., P. WINCH, E. LEONTSINI, G. GLASS, D. SIMON, HAYES E.B., et coll. « Longitudinal evaluation of an educational intervention for preventing tick bites in an area with endemic Lyme disease in Baltimore County, Maryland », American journal of epidemiology, vol. 157, no 11 (2003), p. 1039-1051.
VAUGHN M.F. et S.R. MESHNICK. « Pilot study assessing the effectiveness of long-lasting permethrin-impregnated clothing for the prevention of tick bites », Vector-Borne and Zoonotic Diseases, vol. 11, no 7 (2011), p. 869-875.